新冠病毒可能采取类似HIV病毒的包装方式,变异引入的酶切位点可能增强传播能力
作者|iBioWorld 来源|iBioWorld(ID:ibioworld)
2019年12月,武汉发生了新型冠状病毒引起的肺炎疫情。基于基因组信息,溯源分析的结果支持这一新型冠状病毒源自中华菊头蝠,但与SARS冠状病毒有较大差异,这一结果与两者临床症状差异一致。基因组分析表明,该新型冠状病毒属于β冠状病毒。
前期研究还发现了β冠状病毒存在大量的可变翻译,并从分子水平揭示了该病毒变异快、多样性高的特点。
近日,南开大学高山 、阮吉寿等在中国预印本 ChinaXiv 发表题为:《武汉2019冠状病毒S蛋白可能存在Furin蛋白酶切位点》的论文。
该论文在国际上首次报道此次新冠病毒的一个重要变异,这个变异引入了一个可供Furin蛋白酶切的位点,是此前所有发现的SARS和SARS样(SARS-like)冠状病毒所不具备的。这种变异有可能增强了新冠病毒的传播能力。
本研究的主要结论:
(1)新型冠状病毒S蛋白可能存在Furin 蛋白酶切位点,其包装机制有可能与鼠肝炎冠状病毒、HIV、埃博拉病毒等的包装机制相同,而不同于SARS 等其它大部分β冠状病毒;
(2)由于包装机制的改变,新型冠状病毒S蛋白获得了更高的侵染细胞的效率,这可能是其传播能力大于SARS 冠状病毒的一个原因;
(3)一些禽流感病毒也可以通过突变获得一个Furin 蛋白酶切位点,以提高其侵染细胞的效率。

已知的多种RNA病毒感染入侵的第一步是通过病毒的膜融合蛋白与靶细胞结合。其中,SARS冠状病毒S蛋白(Spike protein)、HIV包膜糖蛋白(Envelope glycoprotein, Env)、流感病毒的血凝素(Hemagglutinin,HA)和埃博拉病毒的糖蛋白(Glycoprotein,GP)等为I类膜融合蛋白。
HIV病毒与SARS冠状病毒都是包膜病毒,都可以通过膜融合途径进入细胞。两种病毒侵染时都需要融合蛋白被细胞蛋白酶切割,得到一个受体结合结构域,一个膜融合结构域和一段交界区(Junctional region)。
两种病毒不同之处在于:HIV病毒的gp160在细胞内包装过程中被Furin蛋白酶切割,分泌出的病毒颗粒表面的gp120(负责与受体结合)和gp41(负责膜融合)是分开的两个亚基;而SARS冠状病毒S1与S2之间的交界区没有Furin蛋白酶切位点(cleavage site),所以分泌出的病毒颗粒表面的S蛋白(Spike Protein)中的S1(负责与受体结合)和S2(负责膜融合)仍是融合状态。
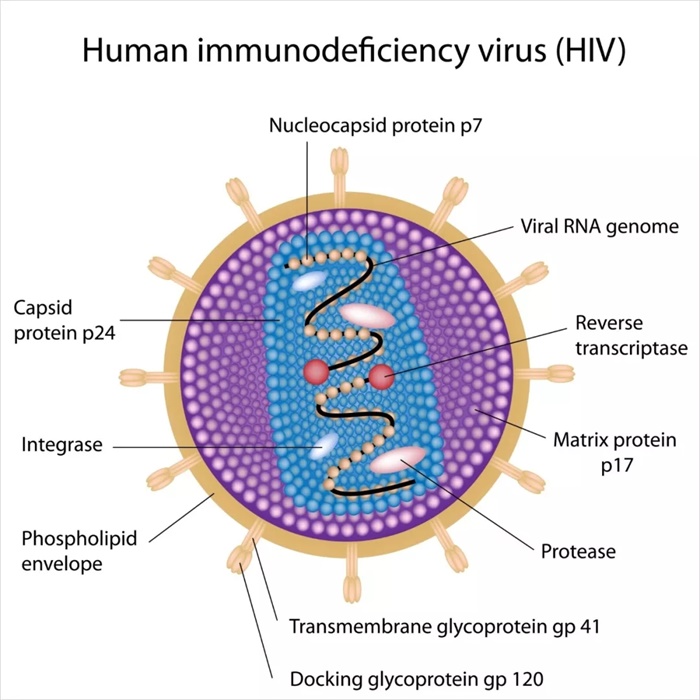
HIV病毒结构
SARS冠状病毒通过两种方式侵染宿主细胞,一种是病毒在侵染时,S蛋白被细胞表面其它蛋白酶(如胰蛋白酶Trypsin)切割成为S1和S2两个亚基,进而直接与宿主细胞膜融合侵入胞内;另一种则是通过胞吞途径进入宿主细胞,而后S蛋白被溶酶体内的组织蛋白酶切割然后再通过膜融合侵染。研究显示前一种方式的侵染效率是后者的约100到1000倍。
有关SARS冠状病毒感染入侵过程中的很多机制尚不清楚,因此阻碍了药物、疫苗和抗体开发等应用。基于大量基因组数据的研究,特别是针对S蛋白区域的变异研究,不仅可以深入了解BB冠状病毒的感染机制,而且有助于揭示新型冠状病毒感染的特点,为病毒防控以及治疗奠定基础。
本研究在前期工作基础上,无意间发现了新冠病毒基因组可能存在Furin蛋白酶切位点。
这一发现暗示了新冠病毒可能在感染途径上与SARS冠状病毒有较大差异,该病毒可能采用了鼠肝炎冠状病毒、HIV、埃博拉病毒和一些禽流感病毒的包装机制。
这个发现,为当前新冠病毒感染的治疗提供理论支持。已有的大量相关病毒(例如HIV)治疗药物都可以考虑以“老药新用”的方式进行组合,与免疫抑制剂等药物联合用药,以提高治疗效果或降低免疫抑制剂副作用。
本研究的思路和方法对研究病毒变异,以及药物、抗体和疫苗的开发等依然有指导意义。如果Furin蛋白酶切位点及相关机制预测正确,意味着现有的大量抗病毒药物(特别是Furin蛋白酶抑制剂)可以利用,实现老药新用。
论文链接:
https://doi.org/10.12074/202002.00004c
编者按:本文转载自微信公众号:iBioWorld(ID:ibioworld)
广告、内容合作请点这里:寻求合作
咨询·服务

