前瞻生物医药产业全球周报2022第15期:HPV疫苗两剂次接种程序在华获批,辉瑞将在葛兰素史克分拆后出售Haleon股份



HPV疫苗两剂次接种程序在华获批
近日,葛兰素史克(GSK)宣布,根据国家药品监督管理局(NMPA)的审评结果,其HPV疫苗希瑞适(双价人乳头瘤病毒吸附疫苗[HPV16/18型])适用于9-14岁女孩的两剂次接种程序已获得批准。由此,希瑞适成为中国获批9-14岁女孩两剂次接种程序的首个进口HPV疫苗。
辉瑞将在葛兰素史克分拆后出售Haleon股份
最新消息显示,葛兰素史克将于7月完成分拆为两家公司,一家是专注于制药业务的新葛兰素史克公司,而另一家则是独立的消费者健康业务公司Haleon。不过,葛兰素史克的合作伙伴辉瑞(Pfizer)日前却表示,打算在该公司分拆后出售拥有的Haleon股份。目前,葛兰素史克持有Haleon 68%的股份,辉瑞持有32%的股份。

《局部给药局部起效药物临床试验技术指导原则》发布
5月30日,国家药品监督管理局药品审评中心发布《局部给药局部起效药物临床试验技术指导原则》的通告,以解决局部给药局部起效药物剂型众多、辅料复杂、给药途径多样的难题,该难题与系统给药药物相比,其在临床试验设计和审评评价方面存在特殊性,且面临较大困难和挑战。技术指导原则的发布可进一步指导业界、研究者和监管机构在该领域药物的科学研发和评价。
《免疫细胞治疗产品药学研究与评价技术指导原则(试行)》发布
6月1日,为规范和指导免疫细胞治疗产品的药学研发、生产和注册,在国家药品监督管理局的部署下,药审中心组织制定了《免疫细胞治疗产品药学研究与评价技术指导原则(试行)》。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。

沃森生物/蓝鹊生物新冠mRNA疫苗将启动一期临床
5月27日,沃森生物在Clinicaltrials.gov网站了登记了新冠mRNA嵌合疫苗RQ3013的一期临床。该一期临床计划入组120例健康志愿者,预计8月完成。根据公开信息,RQ3013又蓝鹊生物研发,是一款基于阿尔法/贝塔突变株S蛋白嵌合体设计的双价mRNA疫苗,该疫苗在动物试验中对多种变异株均能产生高效价中和抗体,是一种广谱保护的新冠变异株mRNA疫苗。
辉瑞Paxlovid在美国成为治疗新冠主选药物
辉瑞公司开发的新冠药已成为美国治疗新冠的最主要处方药,该药的供应情况已经改善,有更多的药房售卖该药。根据药物数据公司Iqvia Holdings的数据,截至5月6日,对于辉瑞公司抗病毒药物Paxlovid开出的处方总数在美超过41.2万张,而默沙东和Ridgeback Biotherapeutics LP的抗病毒药物molnupiravir的处方数约为11万张。
先声药业3CL口服小分子新冠药提前完成I期研究
6月1日,据山东省千佛山医院官网消息,先声药业3CL口服小分子新冠药SIM0417(SSD8432)在健康成年受试者中单次/多次给药后的安全性、耐受性及药代动力学的I期临床研究完成了最后一例受试者给药及院内观察。本研究主要研究者赵维主任表示:在双方共同努力下,SIM0417的I期研究提前完成末例患者给药,药物安全性良好,没有出现与SIM0417相关联的停药事件。
首个mRNA新冠疫苗中国人群二期临床主要研究结果公布
5月30日,医学学术期刊《柳叶刀》已于日前刊发了复星医药mRNA新冠疫苗“复必泰”在中国境内的二期临床研究主要研究结果:在健康或患有稳定的基础疾病的中国成年人中,间隔21天接种2剂复必泰可诱导强烈的免疫应答,并且安全性良好。这是首个披露中国人群二期临床数据的mRNA新冠疫苗。该疫苗由德国百欧恩泰(BioNTech)研发,2020年3月,复星医药获权在中国大陆及港澳台地区独家开发及商业化。

企业布局
GSK拟以33亿美元收购疫苗公司Affinivax
5月31日,葛兰素史克表示,已同意以至多33亿美元的价格收购临床阶段生物制药公司Affinivax,以加强其疫苗管线。款项包括首付款21亿美元,并为潜在的发展里程碑支付至多12亿美元,交易预计将在2022年第三季度完成。这是今年继辉瑞116亿美元收购Biohaven后,制药领域第二大并购。
企业合作
多禧生物与杨森就ADC药物达成合作和许可协议
6月1日,多禧生物宣布与强生公司旗下杨森达成合作和许可协议。根据该协议规定,多禧生物将应用其独有的ADC创新平台与杨森所提供的独有抗体,双方将就至多5个靶点开发新型ADC药物。强生创新协助促成该合作协议,强生创新旗下投资公司-JJDC也对多禧生物进行了股权投资。
人事变动
未名医药副总经理李頵离职
5月31日,未名医药公告称,公司董事会近日收到公司副总经理李頵先生提交的辞职报告,李頵先生因个人原因申请辞去公司副总经理职务,辞职后李頵先生将不再担任公司任何职务。据了解,李頵担任未名医药副总经理的任职日期为2022年1月26日。其从任职到离职只用了不到半年的时间。
京新药业董事辞职
5月31日,京新药业发布公告称,由于个人家庭原因,侯建申请辞去公司董事职务,辞职后将不在公司及公司控股子公司任职。侯建未直接持有公司股份,其配偶或其他关联人亦未持有本公司股份。
信达生物任命Gary Zieziula先生为董事会成员
6月1日,信达生物宣布任命Gary Zieziula先生为其董事会成员。Zieziula先生将作为独立非执行董事,担任信达董事会的审计委员会和战略委员会成员。据悉,Gary Zieziula先生在医药行业拥有40多年的工作经验,曾于多家跨国医药公司担任重要职务,成功组建及领导团队在欧洲及北美进行商业化活动。Zieziula先生目前担任Kyowa Kirin北美子公司总裁和北美区域负责人。
纽福斯聘任郭晓宁博士为首席医学官
6月1日,纽福斯生物科技有限公司宣布聘任国际临床经验丰富的郭晓宁博士为首席医学官。郭博士将全面负责公司全球研发从临床前到临床开发工作,实施管线管理策略,参与公司整体战略布局,把控产品管线研发的全流程。
复星医药CMO回爱民卸任
6月2日,据复星医药官方消息,因为疫情和个人原因,回爱民博士将卸任复星医药高级副总裁、全球研发总裁兼首席医学官;并将转为担任公司顾问,参与复星医药全球研发和临床相关工作。此外,复星医药公告指出,吴以芳不再担任公司首席执行官,将由文德镛获委任为公司首席执行官,陈玉卿为公司联席首席执行官,任期为三年。

诺华:CAR-T疗法斩获第三项适应症
诺华公司宣布,美国FDA加速批准其CAR-T疗法Kymriah(tisagenlecleucel)用于治疗接受过两种以上全身性治疗的复发/难治性滤泡性淋巴瘤患者。新闻稿指出,这是FDA批准的Kymriah的第三项适应症。该批准基于II期ELARA试验的数据,这是一项单臂、开放标签试验,评估了90名患者的疗效。中位随访时间约为17个月,接受治疗的患者中有86%获得缓解,其中68%获得完全缓解。获得完全缓解的患者中,有85%的患者在首次获得缓解12个月之后仍然维持缓解。
恒瑞医药:恒格列净二甲双胍复方缓释片上市申请获受理
据恒瑞医药官微消息,其子公司山东盛迪医药有限公司研发的新药HR20033片(脯氨酸恒格列净二甲双胍复方缓释片)上市许可申请获得国家药品监督管理局受理。本品配合饮食控制和运动,适用于适合接受脯氨酸恒格列净和盐酸二甲双胍治疗的2型糖尿病成人患者,以改善此类患者的血糖控制。
信立泰SAL0112片临床试验申请获受理
5月30日,信立泰发布公告称,于近日收到国家药监局核准签发的受理通知书,公司自主研发的创新小分子化学药物SAL0112片临床试验申请获得受理。SAL0112片为胰高血糖素样肽-1受体(GLP-1R)的口服小分子偏向激动剂,拟开发适应症包括2型糖尿病(T2DM)。
诺和诺德:口服司美格鲁肽在中国递交上市申请
CDE官网公示,诺和诺德在中国递交了司美格鲁肽片的上市申请,并获受理。公开资料显示,司美格鲁肽为一款一种长效胰高血糖素样肽-1受体(GLP-1R)受体激动剂,它的注射剂型此前已在中国获批。司美格鲁肽片是是司美格鲁肽和吸收促进剂(SNAC)的复合制剂。SNAC能够升高局部pH、减少胃蛋白酶降解,帮助司美格鲁肽实现胃内跨细胞吸收,从而增加口服给药途径的生物利用度。
英国NICE批准默沙东Keytruda用于三阴性乳腺癌成年患者
日前,英国国家健康与护理卓越研究所(NICE)宣布,推荐默沙东Keytruda疗法用于治疗罕见的三阴性乳腺癌成人患者。英国NICE独立专家评估委员会一致认为,Keytruda组合疗法在预期寿命较短的患者中达到了延长寿命治疗的成本效益阈值。据估计,每年约有100名三阴性乳腺癌患者将可能会受益于Keytruda疗法的治疗。来自临床试验的相关证据也表明,与其他可用的治疗方法相比,Keytruda与化疗联用能够增加患者的预期寿命,并且能够延长患者癌症发生进展的时间。
美国FDA批准Evrysdi(利司扑兰)
罗氏(Roche)旗下基因泰克近日宣布,美国食品和药物管理局(FDA)已批准口服药物Evrysdi,可用于治疗2个月以下患有脊髓性肌萎缩症(SMA)的婴儿。Evrysdi是一种运动神经元生存基因2(SMN2)mRNA剪接修饰剂,通过提高运动神经元生存蛋白(SMN)的产生来治疗SMA。SMN蛋白遍布全身,对维持健康的运动神经元和运动至关重要。Evrysdi能够持续增加和维持中枢神经系统和外周组织中的SMN蛋白水平。
白云山分公司:BYS10片获得美国FDA药品临床试验批准
据广州白云山医药集团公告,其分公司BYS10片获得美国FDA药品临床试验批准,用于治疗RET(REarranged during Transfection, 转染重排,属于一种原癌基因)融合或突变的晚期实体瘤。白云山制药总厂拟于近期条件具备后开展该新药针对上述适应症的开放性、多中心I期临床试验。BYS10片是白云山制药总厂研发的选择性RET小分子抑制剂,制剂规格25mg、100 mg,适应症为RET融合或突变的晚期实体瘤(包括非小细胞肺癌、甲状腺癌、甲状腺髓样癌等)。

单抗/双抗
康方与轩竹生物达成PD-1单抗+AXL抑制剂联合治疗合作
5月30日,中国生物制药发布公告称,天晴康方与轩竹生物达成联合治疗合作协议,协议双方就康方的派安普利PD-1单抗与轩竹生物的AXL抑制剂将展开联合探索实验,共同开发联合治疗在实体瘤中的应用。本次合作,将充分发挥康方生物在大分子肿瘤免疫治疗和轩竹生物在小分子靶向治疗领域的专业优势,探索免疫联合疗法在非小细胞肺癌等领域的应用,惠及更多癌症患者。
复宏汉霖PD-L1/TIGIT双抗启动临床
5月30日,Insight数据库显示,复宏汉霖PD-L1/TIGIT双抗HLX301在国内启动临床。HLX301是复宏汉霖自主研发的创新PD-L1/TIGIT双特异性抗体,拟用于多种晚期实体瘤治疗。其中TIGIT结合域来源于公司人源化羊驼重链可变区单域抗体(VHH)噬菌体展示库筛选出的对TIGIT具有高亲和力、高特异性的VHH片段。
阿达木单抗生物类似药获批2项新适应症
6月1日,信达生物宣布,其开发的全人源化重组人抗肿瘤坏死因子-α(TNF-α)单克隆抗体苏立信(阿达木单抗生物类似药)正式获得中国国家药品监督管理局(NMPA)批准两项新适应症,用于成人和儿童克罗恩病的治疗,这也是该产品获批的第七和第八项适应症。
基石药业舒格利单抗新适应症获批
6月2日,中国国家药监局(NMPA)发布的药品批准证明文件显示,基石药业抗PD-L1单抗舒格利单抗注射液的新适应症申请已在中国获批。根据基石药业早前发布的新闻稿,舒格利单抗本次获批“用于同步或序贯放化疗后未发生疾病进展的不可切除的III期非小细胞肺癌(NSCLC)患者巩固治疗”。
两种基于免疫疗法纳武利尤单抗的方案获批
近日,美国FDA批准两种基于免疫疗法纳武利尤单抗(Opdivo,即O药)的治疗方案(O药与含氟嘧啶和含铂化疗联用;O药与伊匹木单抗(Y药)联用)作为一线疗法,治疗晚期不可切除或转移性食管鳞状细胞癌(ESCC)。该研究的主要终点包括PD-L1阳性人群的总生存期(OS)和无进展生存期(PFS)。次要终点包括所有患者的OS和PFS以及客观缓解率(ORR)。
先进疗法
应世生物公布IN10018初步临床数据
5月30日,应世生物宣布在2022年美国临床肿瘤学会年会(ASCO 2022)公布旗下在研管线IN10018一项Ib期临床初步结果。数据显示,IN10018联合脂质体多柔比星(PLD),在治疗铂耐药复发卵巢癌患者中表现出极具潜力的抗肿瘤疗效和良好可控的安全性。该项研究在大会期间将以壁报(Poster #:445)形式展出。IN10018是一种高效和高选择性的黏着斑激酶(Focal adhesionkinase,FAK)抑制剂,正在开发用于包括铂耐药卵巢癌、NRAS突变型转移性黑色素瘤、三阴乳腺癌、头颈部肿瘤、胰腺癌等多种缺乏有效治疗方案的实体瘤适应症,其中IN10018联合PLD治疗铂耐药复发卵巢癌已于2021年8月获得了美国食品药品监督管理局(FDA)的快速通道认证
百时美施贵宝公布CD19 CAR-T细胞疗法
百时美施贵宝(BMS)近日公布了2期PILOT研究的主要分析结果。其中该研究正在评估CD19 CAR-T细胞疗法Breyanzi(lisocabtagene maraleucel,liso-cel)的疗效和安全性。Breyanzi是一种差异化的CD19导向的CAR-T细胞疗法。2020年2月,Breyanzi获得美国FDA批准,用于治疗先前已接受过2种或2种以上系统疗法的R/R LBCL成人患者,包括未另行规定的弥漫性大B细胞淋巴瘤(DLBCL,包括由惰性淋巴瘤引起的DLBCL)、高级别B细胞淋巴瘤(HGBL)、原发性纵隔大B细胞淋巴瘤(PMBCL)、滤泡性淋巴瘤3B级。Breyanzi不适用于原发性中枢神经系统(CNS)淋巴瘤患者的治疗。
Iovance公布lifileucel在晚期黑色素瘤中的II期数据
5月30日,生物科技公司Iovance Biotherapeutics在美国临床肿瘤学会(ASCO)年会之前发布了肿瘤浸润淋巴细胞产品lifileucel在晚期黑色素瘤中的II期数据。C-144-01研究涉及178名不可切除或转移性黑色素瘤患者,他们在先前的抗PD-1/L1治疗中进展,如果BRAF阳性,也已经接受过BRAF或BRAF/MEK抑制剂治疗。Iovance表示,在有87名患者的注册队列4中,客观缓解率(ORR)为29%,其中3例完全缓解,22例部分缓解。此外,中位缓解持续时间(DOR)为10.4个月,中位随访时间为23.5个月。
诺华乐观预期Scemblix未来销量
5月30日,最新数据显示,诺华的来自患者接受药物治疗96周后的3期Ascembl试验中,37.6%接受Scemblix治疗的慢性髓性白血病(CML)患者出现了主要分子反应,而这些患者此前曾尝试过至少两种先前的治疗方法,Scemblix的主要分子反应率率也远高于辉瑞Bosulif的15.8%。诺华公司首席执行官Vas Narasimhan在公司第一季度财报电话会议上表示,Scemblix已经在CML中获得了20%的市场份额,并在三线及其他治疗中成功斩获了49%的患者总份额。
InstilBio首个相关产品获FDA临床许可
5月31日,临床阶段的生物制药公司Institl Bio宣布,其首个用于治疗非小细胞肺癌(NSCLC)、卵巢癌和肾细胞癌(RCC)的基因工程共刺激抗原受体肿瘤浸润淋巴细胞(CoStAR-TIL)疗法ITIL-306获得FDA的临床许可,并将在2022年ASCO年会上展示支持性的CoStAR T细胞体内实验数据。
西奥罗尼治疗小细胞肺癌Ib/II期临床试验申请获批
《科创板日报》5月31号报道,微芯生物公告,公司收到国家药监局签发的关于西奥罗尼胶囊的《药物临床试验批准通知书》,西奥罗尼治疗广泛期小细胞肺癌Ib/II期临床试验申请获得批准。
KRAS靶向T细胞疗法展现抗癌潜力
6月2日,著名医学期刊《新英格兰医学杂志》发表的一项研究显示,使用靶向癌细胞表达的KRAS G12D突变体的自体T细胞疗法,一名接受过多种前期治疗的患者获得深度并且持久的肿瘤缩小。《新英格兰医学杂志》专门为这项研究发表了两篇评论文章,著名学者Eric Topol也在推特上发文表示这是一项开创性(groundbreaking)研究。
长效血友病A疗法获FDA突破性疗法认定
6月2日,赛诺菲(Sanofi)公司宣布,美国FDA授予该公司与Sobi合作开发的efanesoctocog alfa(BIVV001)突破性疗法认定,用于治疗血友病A患者。新闻稿指出,这是首个获得突破性疗法认定的凝血因子VIII(FVIII)疗法。Efanesoctocog alfa是一款长效血友病A疗法,目标是通过每周一次预防性治疗,在一周的大部分时间中维持接近正常的FVIII活性。
JAK抑制剂3期临床结果积极
Concert Pharmaceuticals宣布,3期临床试验THRIVE-AA1获得积极顶线结果,该试验评估了其口服在研药物CTP-543在成人中度至重度斑秃患者中的疗效。根据新闻稿,在THRIVE-AA1研究中,CTP-543在8 mg和12 mg两种研究剂量下均达到让头皮毛发再生的主要终点和关键次要终点。早在治疗第八周即可观察到具有统计学意义的头发再生。
阿斯利康宣布Ultomiris3期临床试验中达到主要终点
阿斯利康(AstraZeneca)宣布,旗下Alexion公司开发的一种长效补体C5蛋白抑制剂Ultomiris(ravulizumab-cwvz)在治疗视神经脊髓炎谱系疾病(NMOSD)的3期临床试验中达到主要终点。NMOSD是一种罕见的失能性中枢神经系统自身免疫性疾病。本次公布的3期临床试验结果显示,中位治疗时间为73周时,在接受Ultomiris治疗的58名患者中没有观察到疾病复发,达到了试验的主要终点。此前,Ultomiris已获美国FDA批准治疗阵发性睡眠性血红蛋白尿和重症肌无力等自身免疫性疾病。
特比澳3期临床中达到预设主要终点
三生制药宣布,特比澳在一项针对儿童或青少年的慢性原发性免疫性血小板减少症(ITP)的3期临床中达到预设的主要终点。特比澳是一款重组人血小板生成素注射液,此前已在中国获批用于治疗化疗引起的血小板减少症和ITP患者。本次针对儿童ITP患者的3期临床研究显示,与对照组相比,试验组有优效性,两组总体有效率具有统计学差异。研究过程中未发生与研究药物有关的严重不良事件或任何可疑的非预期严重不良反应。三生制药计划于近期向中国国家药品监督管理局(NMPA)递交该适应症的新药上市申请。

传奇生物一季度业绩发布:收入4082.7万美元财务
6月1日,传奇生物正式公布其2022Q1未经审核业绩。报告显示,公司2022年第一季度的未经审核财务业绩,收入4082.7万美元,同比增长约1.98倍;研发开支8134.6万美元,同比增长约14.46%。
美敦力发布2022年财报:总营收达316.86亿美元
6月2日,美敦力官方微信发布2022财年业绩,2022财年全年收入316.86亿美元(2122.5亿人民币),增长5%。心血管产品组合:收入为114.23亿美元,增长6%;医疗外科产品组合:收入为91.41亿美元,增长5%;神经科学产品组合:收入为87.84亿美元,增长7%;糖尿病:收入为23.38亿美元,下降3%。美敦力预计其2023财年的收入增长将在4%至5%之间。如果近期外汇汇率保持不变,2023财年的收入将受到约10亿至11亿美元的负面影响。
基石药业发布2021年度业绩公告:亏损达19亿
5月31日晚间,基石药业发布2021年度业绩公告。公告显示,2021年公司总收入为2.437亿元,包括药品销售收入(指本公司销售新上市药品阿伐替尼及普拉替尼)1.628亿元,授权费收入为0.809亿元。亏损达19.201亿元,较2020年度的12.21亿元增加6.991亿元。

惠升生物完成5亿元A轮融资
四环医药控股集团有限公司宣布,集团旗下非全资附属公司惠升生物完成了5亿元A轮融资。本轮融资由国寿大健康基金、天津远翼、天津远翼吉茂、银杏资本共同注资。
原能生物完成4.1亿元A轮融资
原能细胞科技集团旗下上海原能细胞生物低温设备有限公司(下称“原能生物”)宣布完成4.1亿元人民币的A轮融资。本轮融资在原股东上市公司开能健康(证券代码:300272)、华丽家族(证券代码:600503)、高森系列基金及员工持股平台续投的基础上,公司创始人、董事长瞿建国先生及丽水高森基金等进行了积极跟投。
顿慧医疗完成数亿元A轮融资
上海顿慧医疗科技发展有限公司于近日完成数亿元A轮融资,由鲁信创投和同创伟业旗下基金共同领投,前海基础、趣道资产、金投致源参与投资。获得本轮融资后,公司将进一步加大原研投入力度、加强人才团队建设、提高企业生产能力,持续推进重点研发项目的成果转化及商业化。生命资本担任本次融资独家财务顾问。
Transine Therapeutics完成种子轮投资
生物技术公司Transine Therapeutics宣布完成460万英镑的额外种子轮融资。本轮融资由新投资者 Epidarex Capital领投,现有投资者Dementia Discovery Fund (DDF)跟投。

中健康桥IPO上会被否
6月6日,中国证券监督管理委员会第十八届发行审核委员会2022年第63次发审委会议于2022年6月2日召开,审核结果显示,中健康桥医药集团股份有限公司首发未通过。中健康桥的保荐机构为东兴证券股份有限公司,保荐代表人为刘鸿斌、朱彤。

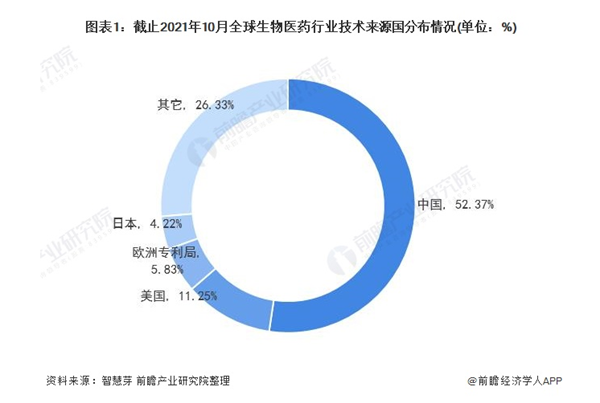
全球生物医药技术来源国分布
目前,全球生物医药第一大技术来源国为中国,中国生物医药专利申请量占全球生物医药专利总申请量的52.37%;其次是美国,美国生物医药专利申请量占全球生物医药专利总申请量的11.25%。欧洲专利局和日本占比分别为5.83%和4.22%。
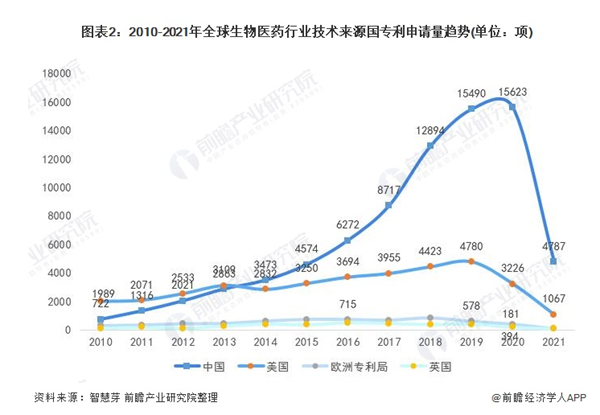
全球生物医药专利申请趋势
从趋势上看,2010-2013年,美国生物医药专利申请数量较多,但是在2014年后被中国反超并逐渐拉开距离。2020年,中国生物医药专利申请量为15623项,美国生物医药专利申请量下降至3226项。欧洲专利局和英国生物医药专利申请量呈现“你追我赶”的态势,两国每年度专利申请量差距不大。2020年,欧洲专利局生物医药专利申请量为394项,英国生物医药专利申请量为181项。

从学术到产业,更多定制化产业周刊(全球产业舆情监测、前沿技术情报追踪、产融政策权威解读、产业招商精准线索),敬请拨打400-068-7188。同时前瞻产业研究院还提供产业大数据、产业研究、产业链咨询、产业图谱、产业规划、园区规划、产业招商引资、IPO募投可研、IPO业务与技术撰写、IPO工作底稿咨询等解决方案。
广告、内容合作请点这里:寻求合作
咨询·服务
