重磅!2022年中国及31省市血液制品行业政策汇总及解读(全)政策监管日渐收紧
行业主要上市公司:目前国内生物医药行业的上市公司主要有天坛生物(600161)、华兰生物(002007)、博晖创新(300318)、派林生物(000403)、卫光生物(002880)、博雅生物(300294)等。
本文核心数据:政策、规划、目标
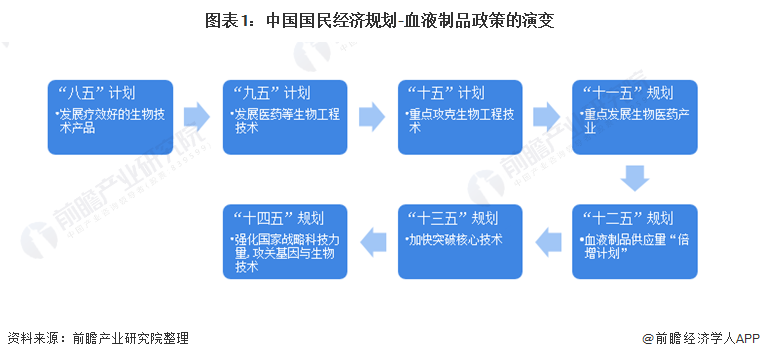
1、政策历程图
血液制品是我国生物医药制造业的重要分支,根据我国国民经济“八五”计划至“十四五”规划,国家对血液制品行业的支持政策主要在于技术,经历了从“发展”到“重点攻克”再到“十二五”期间,国内血液制品供应量“倍增计划”,以及“强化与攻关技术”的变化。
2、国家层面政策汇总及解读
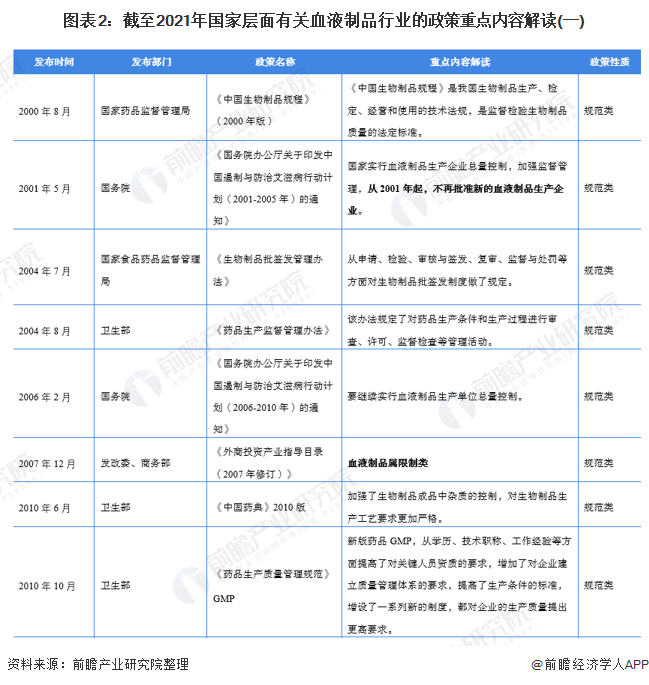
——国家层面血液制品行业政策汇总
自1996年国务院发布《血液制品管理条例》以来,血液制品行业的管控日益收紧。自2001年起,政府不再批准新企业进入血液制品行业,同时更新配套法规,大量中小型血液制品企业退出或被并购,目前仅有约30家企业仍在从事血液制品生产。严格的管控政策为行业内企业筑起护城河。
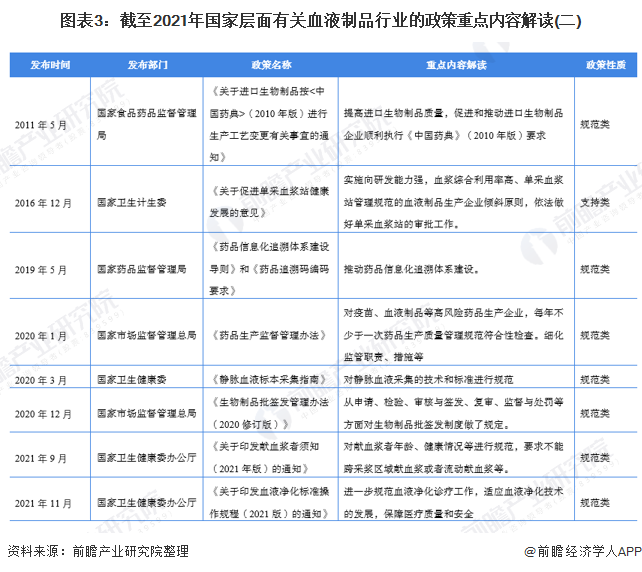
——血浆站采集政策解读
在血浆站采集政策方面,1996年国务院发布首条《血液制品管理条例》,此后直到2006年才再度颁发《单采血浆站质量管理规范》,2008年颁布《单采血浆站管理办法》。2020年取消了固定献血浆者采浆年龄可延长至60周岁的规定,调整为按卫生主管部门要求执行,根据现行的《单采血浆站管理办法》,划定采浆区域内具有当地户籍的18岁到55岁健康公民可以申请登记为供血浆者。

——国家层面血液制品行业管理目标解读
目前,政府对血液制品的管控非常严格,以新增血浆站审批为例,2019年全年全国仅有1家单采血浆站新获批。2020年新冠疫情导致国内采浆量下滑,在浆源有限的情况下,政策却未见宽松,甚至日渐严格。
国家对疫苗类制品、血液制品、用于血液筛查的体外生物诊断试剂等生物制品,每批制品出厂销售前或者进口时必须进行强制性审查、检验和批准,这也是国际通行的做法。

3、各省市层面的政策汇总及解读
——31省市血液制品行业政策汇总
目前,中国药品生物制品检定所负责组织及承担血液制品批签发工作,北京、吉林、上海、湖北、广东、四川、甘肃等省(市)承担生物制品批签发任务的药品检验机构,负责受理指定区域内血液制品生产企业申请批签发工作。
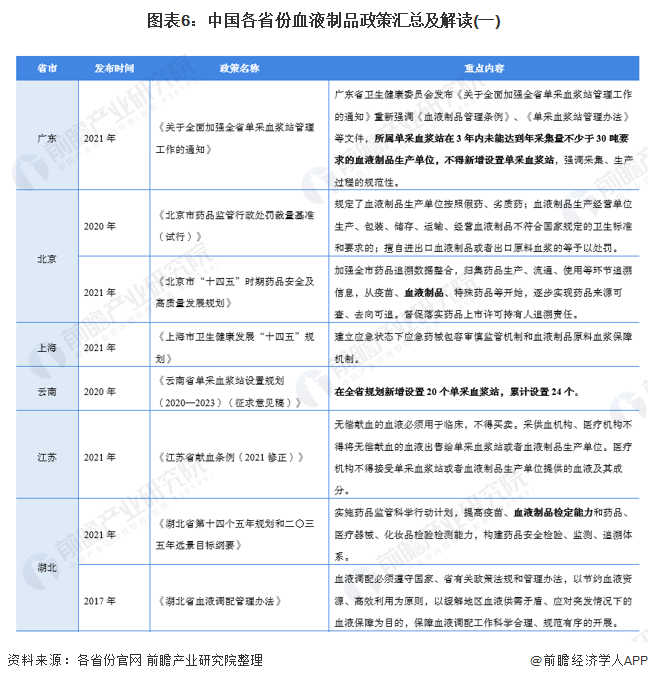

——31省市血液制品行业发展目标解读
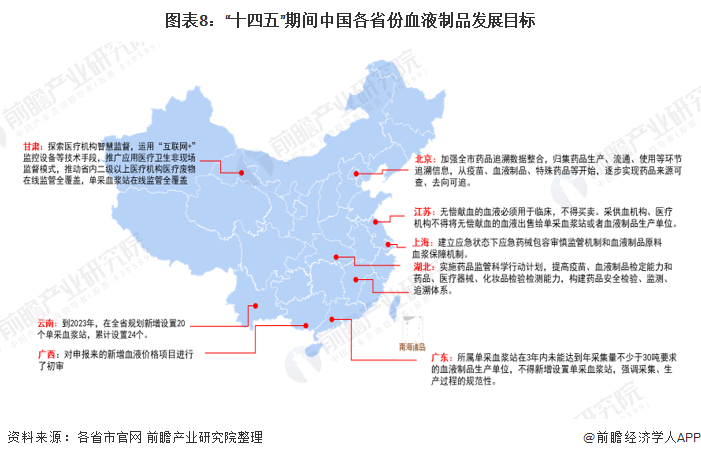
“十四五”期间,我国主要省份也提出了血液制品行业的发展目标。其中,云南全省提出了至2023年新增设置20个单采血浆站,累计设置24个。广东提出2021年,所属单采血浆站在3年内未能达到年采集量不少于30吨要求的血液制品生产单位,不得新增设置单采血浆站,强调采集、生产过程的规范性。此外,北京、甘肃等地也提出了血液制品行业相应的规范标准或规划:
以上数据参考前瞻产业研究院《中国血液制品行业产销需求与投资预测分析报告》,同时前瞻产业研究院还提供产业大数据、产业研究、产业链咨询、产业图谱、产业规划、园区规划、产业招商引资、IPO募投可研、招股说明书撰写等解决方案。
更多深度行业分析尽在【前瞻经济学人APP】,还可以与500+经济学家/资深行业研究员交流互动。
广告、内容合作请点这里:寻求合作
咨询·服务


