一文带你看懂2018年中国药物评审 创新药和进口药物审评速度明显加快
受理新药注册申请数据中生物制品表现优异
2018年药审中心受理的7336件新注册申请中,化药注册申请受理量为5979件,占2018年全部注册申请受理量的82%,2018年各类药品注册申请受理情况与近三年比有较大变化,生物制品受理数量明显增加。
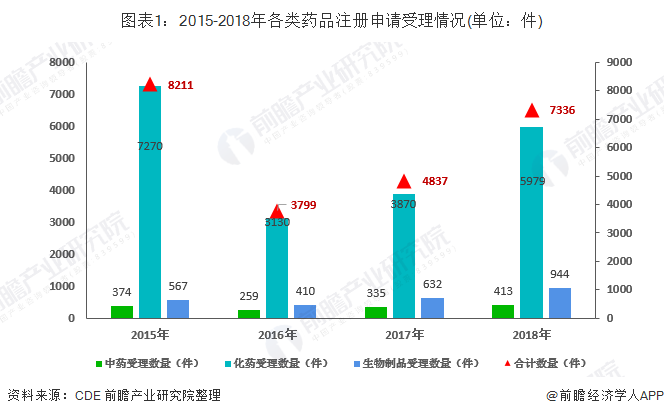
而在需技术审评的5574件注册申请中,化药为4459件,占全部需技术审评的注册申请受理量的80.0%,中药和生物制品注册申请分别为300件和815件。

药品注册申请审评审批按时率达到90%
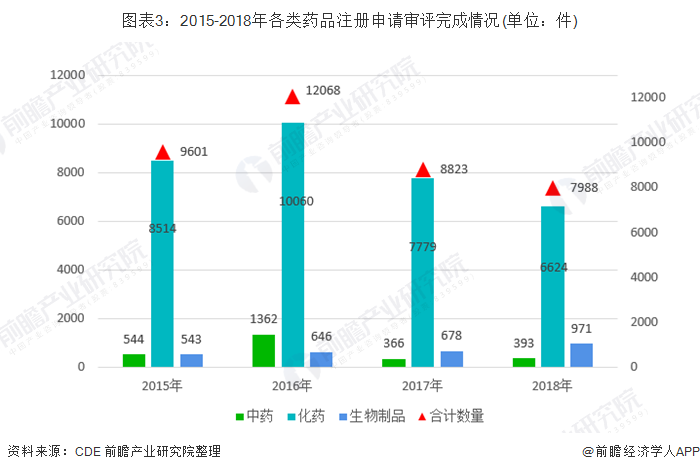
从2018年审评审批完成整体情况来看,2018年底,药审中心实现中药、化药、生物制品各类注册申请按时限审评审批率已超过90%,基本完成了44号文件确定2018年实现按规定时限审批的工作目标。2018年完成审评审批的注册申请共9796件,其中完成需技术审评的注册申请7988件(包含4052件需技术审评的行政审批任务),完成直接行政审批的注册申请1808件。
2018年底排队等待审评审批的注册申请已由2015年9月高峰时的近22000件降至3440件(不含完成审评因申报资料缺陷等待申请人回复补充资料的注册申请),进一步巩固了44号文件要求解决注册申请积压的成效。
近四年在各类药品注册申请审评完成情况中生物制品呈现稳定增长趋势,而中药和化学药品则呈现先增长后下降的趋势。2018年的完成审评的申请中,化药注册申请为6624件,约占全部审评完成量的83%。而生物制品为971件,中药为393件。
各类注册申请审评完成度较好
从CDE的数据来看,2015-2018年已完成的注册申请审评中IND、进口再注册、一致性评价都是呈现稳定上升趋势、其他验证性临床、NDA、ANDA及复审的申请呈现波动趋势。2018年药审中心完成IND申请审评1094件,完成NDA审评296件,完成ANDA审评2388件。

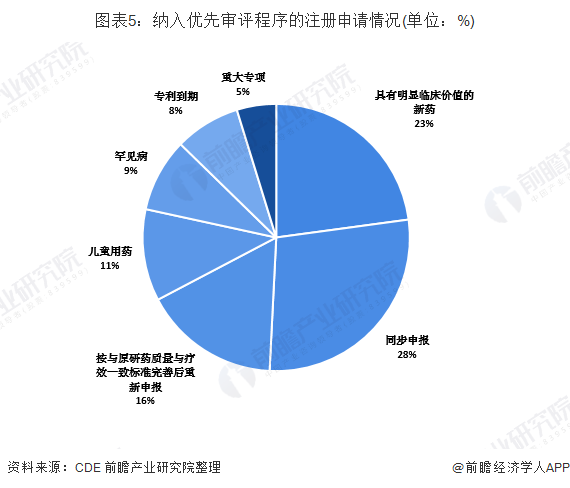
纳入优先审评程序中同步申报的品种占比最大
根据国家食品药品监督管理总局(以下简称原总局)《关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号),2018年,药审中心共将313件注册申请纳入优先审评程序,其中儿童用药和罕见病用药63件。2018年纳入优先审评的注册申请中,同步申报的品种占比最大,占比为28%,其次为具有明显临床价值的新药,占比为23%。
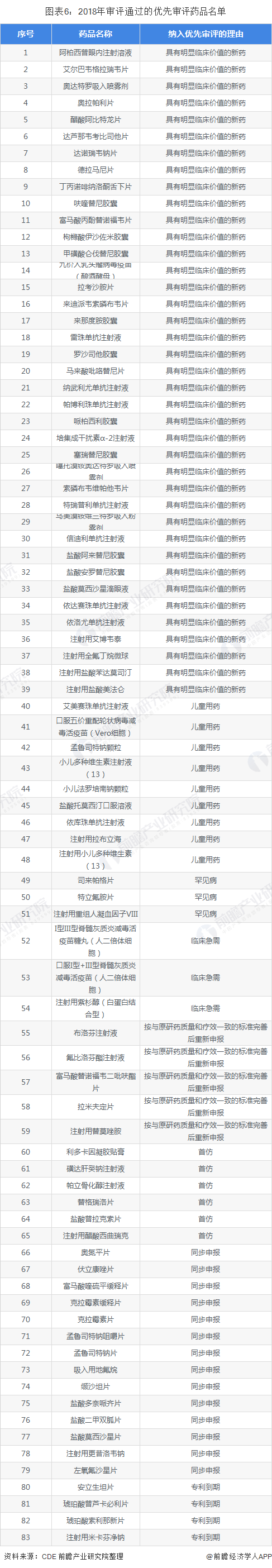
另一方面,2018年共有83个品种通过优先审评程序得以加快批准上市(以通用名计算),如自主研发的注射用艾博韦泰、口服丙肝治疗用新药达诺瑞韦钠片、治疗晚期结直肠癌的小分子血管生成抑制剂呋喹替尼胶囊等药品。
一致性评价稳步进行
为提升我国仿制药质量,根据44号文件、《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号,以下简称国办8号文件)等有关规定,药审中心全力推进仿制药质量和疗效一致性评价(以下简称一致性评价)工作。同时在参比制剂的遴选、梳理289基药品种、完善指导原则体系等方面都取得不错的进展,
2018年受理口服固体制剂一致性评价申请440件(155个品种),其中289基药品种申请267件(81个品种);通过口服固体制剂一致性评价申请111件(57个品种),其中289基药品种申请63件(36个品种)。

第一批临床急需境外新药的审评审批取得进展
除一致性评价之外,药审中心对2007年以来在美国、欧盟或日本批准上市,但尚未在我国境内上市的新药进行梳理,组织专家遴选临床急需新药。现已将第一批48个临床急需境外新药纳入专门通道加快审评,多措并举加大对申请人的服务和指导,上述48个境外新药中已受理17个品种,10个品种已获批上市,7个正在进行技术审评。

创新药审评抗癌药和抗病毒药居多
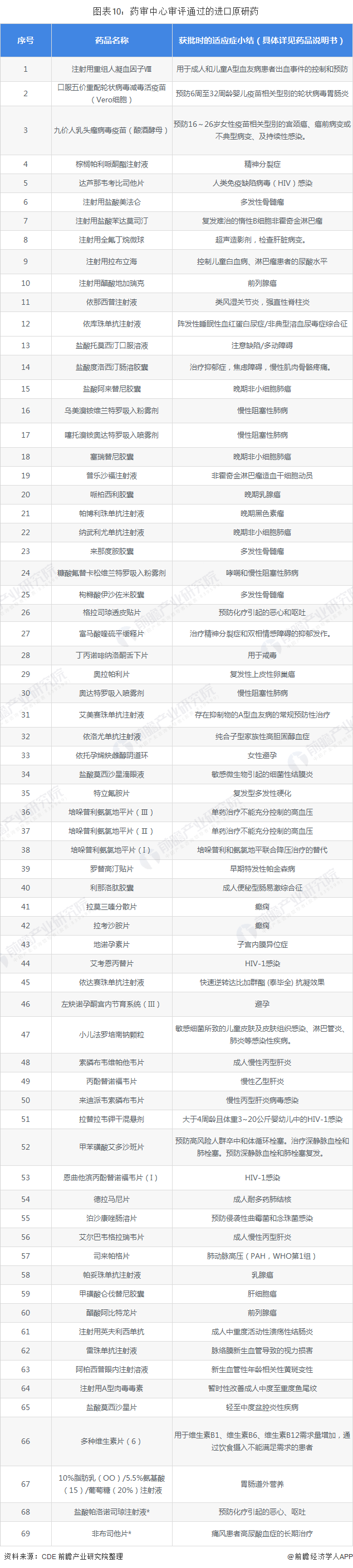
2018年,药审中心审评通过的新药(NDA及IND直接批产)106个(按品种统计),包含关黄母颗粒、金蓉颗粒2个新中药复方制剂,以及9个1类创新药和67个进口原研药。1类创新药全部为我国自主创新药品且以抗癌药、抗病毒药居多,分别是呋喹替尼胶囊、罗沙司他胶囊、马来酸吡咯替尼片、盐酸安罗替尼胶囊、达诺瑞韦钠片、注射用艾博韦泰6个化学新分子实体药物,特瑞普利单抗注射液、信迪利单抗注射液2个抗PD-1单克隆抗体,以及重组细胞因子基因衍生蛋白注射液。

创新药和进口药抗肿瘤和消化系统领域
药审中心受理国产1类创新药注册申请448件(涉及222个品种),其中受理临床申请403件(涉及198个品种),占比90.0%。上市申请45件(涉及24个品种),占比10.0%。按药品类型统计,化药323件(涉及115个品种),中药2件(涉及1个品种),生物制品123件(涉及106个品种),创新药的适应症主要集中在抗肿瘤、内分泌系统和消化系统领域。
药审中心受理5.1类化药进口原研药注册申请75件(涉及50个品种),受理1类进口创新药注册申请85件(涉及42个品种),创新药的适应症主要集中在抗肿瘤、循环系统和消化系统领域。

以上数据来源于前瞻产业研究院《中国医药行业市场前瞻与投资战略规划分析报告》,同时前瞻产业研究院还提供产业大数据、产业规划、产业申报、产业园区规划、产业招商引资等解决方案。
更多深度行业分析尽在【前瞻经济学人APP】,还可以与500+经济学家/资深行业研究员交流互动。
广告、内容合作请点这里:寻求合作
咨询·服务


