2018年中国纳入优先审批程序药物清单解读
为加强药品注册管理,加快具有临床价值的新药和临床急需仿制药的研发上市,2016年2月,我国食药监局出台《总局关于解决药品注册申请积压实行优先审评审批的意见》(目前已废止),2017年底,国家食品药品监管总局发布并实施《关于鼓励药品创新实行优先审评审批的意见》,并将2016年出台政策废止,并对纳入优先审评审批的药品范围进行了详细说明。
政策实施以来,我国创新药物审评审批速度明显提升。根据前瞻产业研究院的统计,截至2018年,我国纳入优先审评审批的药品合计33批次,其中2018年的审评审批次数为8次,药品数量为174件。从近三年的比较来看,2018年我国纳入优先审评审批的药品的批次和件数均为近三年最低。

根据《关于鼓励药品创新实行优先审评审批的意见》,被纳入优先审评审批的药品主要分为7类事项:仿制临床、仿制药上市、新药临床、新药上市、新药生产、以国际多中心临床试验数据申请减免进口注册临床试验以及增加新适应症。
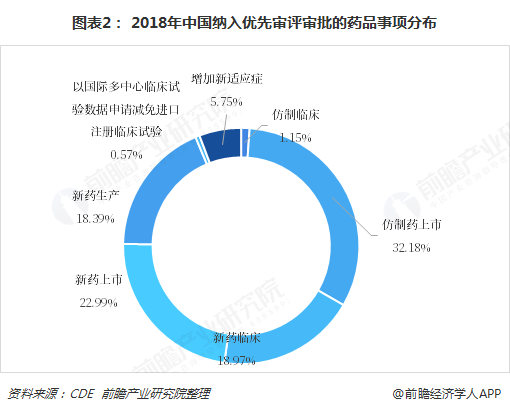
根据前瞻产业研究院汇总整理,2018年我国纳入优先审评审批的药品申请事项分布来看,仿制药上市事项最多,为56件,占比32.18%;其次是新药上市,事项共计40件,占比22.99%;新药临床和新药生产次之,占比分别为18.97%和18.39%。仿制药临床事项和以国际多中心临床试验数据申请减免进口注册临床试验事项分别为2件和1件,占比较小。
从申请理由来看,2018年我国纳入优先审评审批的药品中,以“与现有治疗手段相比具有明显治疗优势”为申请理由的事项共计53项,最多;其次是同一生产线生产,国外已上市,主要为在美国以及欧盟上市产品;居第三位的是儿童药药品(不包含同时为罕见病以及重大专项的儿童用药品),共计23件。其余申请理由事项数量详见下表:

从药品来源分布来看,2018年我国纳入优先审评审批的药品中,124件产品申请人为国内企业,占比71.26%;50件产品申请人为国外企业,占比28.74%。

近年来备受关注的儿童用药和罕见病药也是优先审评审批药品主要申请理由之一,根据前瞻产业研究院的整理,2018年我国儿童药、罕见病及涉及到这两类的申请共计51件,从申请事项分布来看,主要集中在临床、上市两个环节,其中新药临床事项占比达到52.94%。

以上数据来源参考前瞻产业研究院发布的《中国医药行业市场前瞻与投资战略规划分析报告》。
更多深度行业分析尽在【前瞻经济学人APP】,还可以与500+经济学家/资深行业研究员交流互动
广告、内容合作请点这里:寻求合作
咨询·服务


