2020年中国医疗器械行业相关政策及解读分析 “监管+鼓励”双推动行业健康有序发展
“监管+鼓励”双推动医疗器械行业健康有序发展
医疗器械行业作为我国高新技术产业之一,为推动行业健康有序地发展,关于鼓励行业发展、加强对行业监管方面的政策频发。例如,2019年8月,国家药监局发布《关于扩大医疗器械注册人制度试点工作的通知》,加快推进医疗器械产业创新发展;
又如,2020年4月,国家药监局发布《关于发布医疗器械注册人开展不良事件监测工作指南的通告》,加强对医疗器械注册人、备案人的指导、监管力度。总体来看,国家政策在“监管+鼓励”两方面都助力了医疗器械行业的健康有序发展。
1、中国医疗器械产品管理制度分析
根据《医疗器械监督管理条例》,我国对医疗器械类产品的生产流通实现严格的备案、注册管理制度。其中,对第一类医疗器械实行产品备案管理,对第二类、第三类医疗器械实行产品注册管理。

2、中国医疗器械行业相关政策汇总分析
医疗器械行业作为我国高新技术产业之一,为推动行业健康有序地发展,关于鼓励行业发展、加强对行业监管方面的政策频发。例如,2019年8月,国家药监局发布《关于扩大医疗器械注册人制度试点工作的通知》,加快推进医疗器械产业创新发展;
又如,2020年4月,国家药监局发布《关于发布医疗器械注册人开展不良事件监测工作指南的通告》,加强对医疗器械注册人、备案人的指导、监管力度。2017-2020年6月初,有关医疗器械行业的监管、鼓励和规划政策如下:

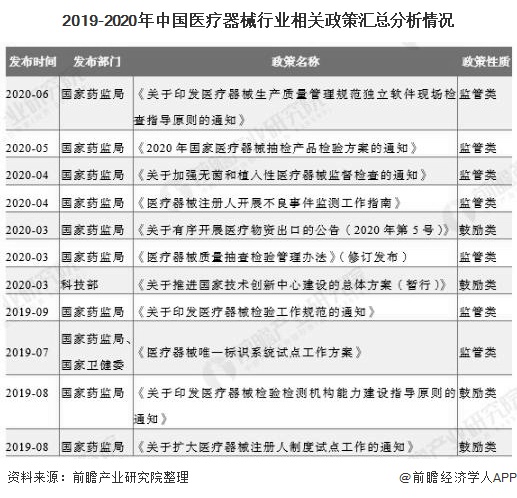
3、中国医疗器械行业重点政策解读分析
——监管类
为指导医疗器械注册人、备案人建立健全医疗器械不良事件监测体系,推进医疗器械不良事件监测工作,及时、有效控制医疗器械上市后风险,2020年4月,国家药监局发布了《医疗器械注册人开展不良事件监测工作指南》,主要内容如下:

——鼓励类
在我国药品医疗器械产业快速发展的背景下,为促进药品医疗器械产业结构调整和技术创新,提高产业竞争力,2017年10月,中国中央、国务院印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,主要意见内容如下:

2019年8月,为贯彻《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,国家药品监督管理局在上海、广东、天津自贸区开展医疗器械注册人制度试点工作的基础上,决定进一步扩大医疗器械注册人制度试点工作,印发了《关于扩大医疗器械注册人制度试点工作的通知》,具体内容下表所示:

以上数据来源及分析请参考于前瞻产业研究院《中国医疗器械行业市场需求预测与投资战略规划分析报告》,同时前瞻产业研究院提供产业大数据、产业规划、产业申报、产业园区规划、产业招商引资等解决方案。
广告、内容合作请点这里:寻求合作
咨询·服务

