科济药业CT041 CAR-T治疗消化系统肿瘤 晚期胃癌疗效数据亮眼
ESMO口头报告
上海2021年9月20日 /美通社/ -- 2021年9月19日,科济药业(股票代码:2171.HK)披露Claudin18.2(CLDN18.2) CAR-T(CT041)治疗消化系统肿瘤的研究者发起试验(IIT)的最新进展,该研究结果已在2021年欧洲肿瘤内科学会大会(2021 ESMO)进行口头报告,报告人为北京大学肿瘤医院沈琳教授团队的齐长松博士。
科济自主研发的CT041为全球唯一获得IND许可的靶向CLDN18.2的CAR-T细胞,目前在中国和美国进行临床试验。该品种在2020年获得美国FDA授予的孤儿药产品资格认定,用于治疗胃癌/食管胃结合部腺癌,并于2021年获得欧洲EMA授予“孤儿药产品”认定,用于治疗胃癌。
实体瘤CAR-T首次亮相ESMO 晚期胃癌临床治疗数据亮眼
本次亮相2021 ESMO口头报告的研究是一项正在中国开展的、多中心、开放标签的I期研究者发起的临床试验,以CT041治疗CLDN18.2表达阳性(≥+,≥10%)的晚期消化系统肿瘤患者。临床试验分为剂量递增阶段和剂量扩展阶段,主要目的是观察CT041的安全性和耐受性,次要目的是观察疗效和药代动力学。
截至2021年4月8日,37例CLDN18.2表达阳性的晚期消化系统肿瘤患者接受CT041输注并完成至少12周的评估,包括28例胃癌/胃食管结合部癌、5例胰腺癌和4例其他类型的实体瘤,细胞输注剂量分别为2.5×108,3.75×108和5×108 CAR-T细胞。约84%的患者既往接受过至少2线治疗,中位转移器官数量为3个。28名胃癌/胃食管结合部癌患者中,67.9%的患者有腹膜转移,42.9%既往接受过抗PD-1/PD-L1单抗药物治疗,35.7%既往接受过TKI药物治疗。
从具体临床数据来看,CT041总体耐受性良好,未发生治疗相关死亡或免疫细胞治疗相关神经系统毒性综合征(ICANS)。约95%的患者发生细胞因子释放综合征(CRS),均为1级或2级。
疗效方面,在36例具有肿瘤靶病灶的患者中,31例患者观察到不同程度的目标病灶缩小,总客观缓解率(ORR)为48.6%,疾病控制率(DCR)为73.0%。
在既往接受至少2线治疗失败、接受II期推荐剂量(RP2D)2.5×108 CAR-T细胞治疗的18例胃癌/胃食管结合部癌患者中,8例(44%)患者既往接受过抗PD-(L)1单抗治疗。中位随访时间为输注后7.6个月,ORR为61.1%,DCR为83.3%,中位PFS和中位OS分别为5.6个月和9.5个月。
在28例胃癌/胃食管结合部癌患者中,亚组分析显示了ORR在CLDN18.2表达水平和既往抗PD-(L)1单抗治疗等不同基线特征情况下均可维持在50%或以上。
历史数据表明,胃癌至少2线治疗失败的患者,化疗药物的有效率约为4%~8%,抗PD-1单抗的有效率约为11%。因此,相比于胃癌末线患者的其他治疗药物,CT041在客观缓解率上已经取得显著提升。由于本期试验中已有较多患者曾经接受过抗PD-(L)1单抗治疗,本期疗效数据,表明CT041有可能成为晚期胃癌患者新的治疗手段。
此临床试验的更多数据后续会在学术期刊或学术会议中进行披露。
群雄逐鹿实体瘤CAR-T疗法 科济药业全球化研发领先
截至目前,全球获批上市的CAR-T 产品的适应症均为血液肿瘤,治疗效果十分显著。

实体瘤与血液肿瘤的细胞治疗试验数量比较,资料来源:Nature Reviews Drug Discovery,长江证券研究所
根据 Nature Reviews Drug Discovery 发布的文章,全球约90%的癌症病例是实体肿瘤,未满足的临床需求仍十分巨大。作为最有希望治愈癌症的疗法之一,CAR-T细胞疗法在实体瘤领域的研发重要性不言而喻,然而不能忽视的是目前国内外CAR-T研发主要集中在血液瘤领域,真正在实体瘤领域勇于探索并且一直坚持的CAR-T治疗公司屈指可数。
究其缘由,主要是因为实体瘤CAR-T细胞疗法的发展面临着诸多挑战,比如实体瘤恶性的肿瘤微环境,肿瘤抗原的异质性和逃逸机制仍有待解决。其中最困难的挑战是理想靶抗原的选择,实体瘤具有显著的抗原异质性、可转移性,导致较难找到类似于CD19这样特异性表达的血液瘤标志物,因此寻找有效靶点成为CAR-T治疗实体瘤的关键突破点。
科济药业是全球第一个成功识别、验证和报告CLDN18.2和GPC3可作为 CAR-T治疗靶点的公司,初步临床数据显示公司相关CAR-T候选产品均有望实现实体瘤治疗的突破。
其中,CLDN18.2表达具有高度特异性,临床研究数据确证了CLDN18.2治疗胃癌、胰腺癌等实体瘤的巨大潜力,全球范围内CLDN18.2靶向药物研发迎来热潮,形成单抗、双抗、ADC及CAR-T药物的全面布局。目前,科济药业已布局该靶点CAR-T疗法和单抗产品,先发优势明显,特别是CAR-T候选产品研发进展领先全球,是唯一获得IND临床实验许可的品种。
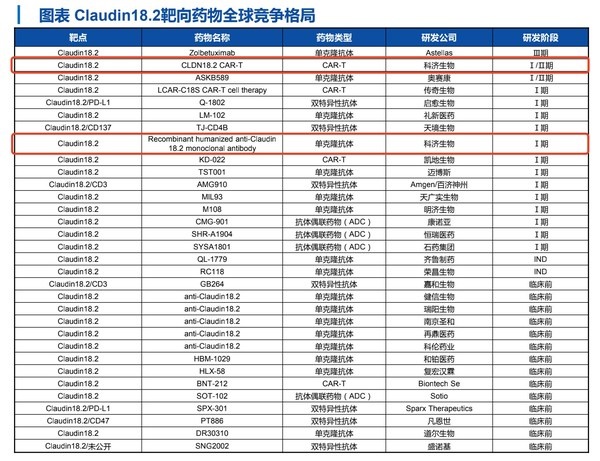
来源:华创证券研报
我国是胃癌的高发国家,大多数患者确诊时已属晚期,并有年轻化的趋势。根据国泰君安研报,晚期胃癌药物治疗方式主要为化疗和 HER2 靶向疗法,但是HER2 在胃癌阳性比例仅为7~20%(中国胃癌患者 HER2阳性率12~13%),覆盖患者不够广泛。虽然一直以来胃癌领域有多个靶点在研,但是近年来药物治疗的突破也还是主要集中在 PD-1 类药物及HER2 靶点药物,胃癌急需出现新靶点的突破,来延长现有的治疗瓶颈。
科济药业已向中国国家药监局递交了启动 CT041 关键 II 期临床试验的申请,预计公司将在 2022 年启动美国的关键II期临床研究。
目前科济药业已拥有11款候选产品,均为自主研发且拥有全球权益,涵盖常规型、新一代CAR-T 技术及同种异体疗法,布局全面且富有前瞻性。科济药业已在中国、美国和加拿大获得7项CAR-T疗法的IND许可,在中国所有CAR-T公司中排名第一。
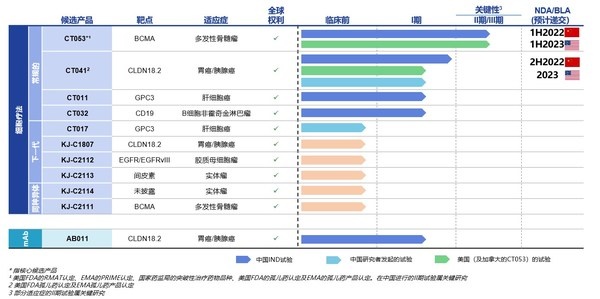
来源:科济药业2021年中期业绩报告
根据Nature Biotechnology文章数据,截至2019年底,按照CAR-T 专利总数统计,全球排名前20家机构及公司中,科济药业是唯一一家上榜的亚洲公司。据科济药业2021年中期业绩报告披露,截至2021年8月15日,科济药业在超过19个国家或地区(包括中国、美国、欧洲及日本)拥有52项授权专利及231项专利申请。

来源:Nature Biotechnology
在现有产品管线基础之上,科济将围绕“实体瘤疗效、安全性、患者可及性、靶点可用性”四大研发战略方向,持续开发创新专有技术 (CycloCAR, THANK-uCAR等),以解决CAR-T疗法领域的主要挑战。未来,这些技术平台也将为临床阶段持续提供更多自主研发候选产品。
北京大学肿瘤医院副院长、消化肿瘤内科主任、Ⅰ期临床病区主任、北京市肿瘤防治研究所副所长沈琳教授表示:胃癌是全球范围高发的肿瘤,特别是在亚洲,中国的胃癌患者约占到全球胃癌患者数量的50%,而胃癌总体的药物研究和治疗手段与其他的实体瘤相比,是相对滞后的,如何改变现有胃癌治疗的困境,一直是大家非常期待的。
这次在ESMO报道的研究结果显示,在晚期胃癌治疗中,CT041具有显著的疗效和良好的安全性,我们期待它能够造福更多的癌症患者。
科济药业创始人、董事会主席、CEO、CSO李宗海博士表示,感谢北京大学肿瘤医院齐长松博士代表研究者团队在ESMO大会上与业界分享CT041的临床研究数据,感谢所有研究者为本项目的倾力付出。这样具有开创性的工作没有研究者的倾力付出是不可能有这样的成果的。当然,为全球胃癌等肿瘤患者提供更好的治疗手段是我们所有人的愿望,也值得我们为之奋斗。
关于CT041
CT041是科济药业自主开发的一种潜在全球同类首创的、靶向CLDN18.2自体CAR-T候选产品,用于治疗CLDN18.2阳性实体瘤如胃癌/胃食管结合部癌及胰腺癌。科济药业在全球率先成功识别、验证并报告CLDN18.2可作为实体瘤CAR-T的合理治疗靶点。除了在中国的研究者发起的试验外,科济药业还在中国启动了针对晚期(不可切除或转移性)胃癌/胃食管结合部癌和胰腺癌的Ib/II期临床试验,在美国启动了针对晚期(不可切除或转移性)胃癌或胰腺癌的Ib期临床试验。
关于科济药业
科济药业(股票代码:2171.HK)是一家在中国及美国拥有业务的生物制药公司,专注于治疗血液恶性肿瘤和实体瘤的创新CAR-T细胞疗法。我们建立了一个综合细胞治疗平台,其内部能力涵盖从靶点发现、抗体开发、临床试验到商业规模生产。我们通过自主研发新技术以及拥有全球权益的产品管线,以解决CAR-T细胞疗法的重大挑战,比如提高安全性,提高治疗实体瘤的疗效和降低治疗成本。我们的使命是成为能为全球癌症患者带来创新和差异化的细胞疗法并使癌症可治愈的全球生物制药领导者。
消息来源: 科济生物医药(上海)有限公司
广告、内容合作请点这里:寻求合作
咨询·服务

