研究人员利用小鼠模型模拟人类新冠感染:肺、气管和大脑显示大量病毒RNA复制
研究人员于5月26日在《细胞宿主与微生物》(Cell Host&Microbe)上发表的研究称,一种感染新冠病毒(SARS-CoV-2)的小鼠模型中,具有人类患者身上所观察到的特征。

研究小组使用CRIPSR/Cas9生成了可以表达hACE2的小鼠模型。参与研究的作者称,与其他表达hACE2的基因工程小鼠相比,他们的小鼠模型具有许多优势,可以模拟SARS-CoV-2感染。
研究人员提出,发现能够模拟和复制在新冠患者患者中观察到的临床病程和病理的小型动物模型,将非常重要——它们将为研究SARS-CoV-2感染和传播提供有用的工具。
研究小组使用CRIPSR/Cas9生成了可以表达hACE2的小鼠模型。这组作者说,与其他表达hACE2的基因工程小鼠相比,他们的小鼠模型具有许多优势,可以模拟SARS-CoV-2感染。

据悉,该病毒在Vero细胞上扩增,并通过标准噬斑形成测定法滴定。简而言之,他们用10倍系列稀释的病毒感染12孔板中的Vero细胞,然后将孔板在37℃下温育1小时,并用低熔点琼脂糖(Promega)覆盖细胞。在37°C下进一步温育2天后,将细胞用4%甲醛固定并用0.2%结晶紫染色以可视化噬菌斑。所有涉及传染性新冠病毒的实验均在AMMS的生物安全等级3(BSL3)遏制实验室中进行。
hACE2不会被随机插入,而是被精确地插入X染色体上的特定位点,并且完全替代了该蛋白的小鼠版本。此外,这是一种遗传稳定的模型,个体之间差异很小。
而且他们发现,肺中病毒RNA的负载要高得多,因此hACE2在各种组织中的分布会更好地与人类观察到的相匹配。
通过鼻子感染新冠病毒后,转基因小鼠显示出在肺、气管和大脑中有强大的大量病毒RNA复制的证据。
“脑中病毒RNA的存在有些出乎意料,因为只有少数COVID-19患者出现了神经系统症状。”中国人民解放军军事医学科学院(AMMS)的共同资深研究员Cheng-Feng Qin表示。
与hACE2结合进入宿主细胞的SARS-CoV-2 S蛋白也存在于肺组织和脑细胞中。此外,研究人员还确定了SARS-CoV-2靶向的主要气道细胞为可产生CC10蛋白的Clara细胞。
“我们的结果提供了显示肺中SARS-CoV-2主要靶细胞的第一线证据。”研究人员称。
此外,小鼠发展出间质性肺炎,影响肺气囊周围的组织和空间,导致炎症细胞浸润,分隔气囊的结构变厚以及血管损伤。
他们还发现,引起年长hACE2小鼠间质性肺炎和细胞因子升高。与年幼的老鼠相比,年长的老鼠表现出更严重的肺损伤,并增加了称为细胞因子的信号分子的产生。综上所述,这些特征概括了在新冠肺炎患者中观察到的特征。
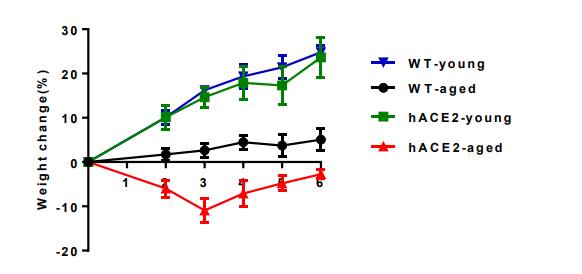
图S1 感染新冠病毒的小鼠的体重变化。年轻(4.5周龄)和老龄(30周龄)小鼠作为对照组,并每日监测体重变化。
当研究人员将新冠病毒注入胃中时,三只小鼠中有两只在气管和肺中显示出高水平的病毒RNA。S蛋白也存在于肺组织中,显示出炎症迹象。这组作者称,这些发现与新冠患者有时会出现胃肠道症状,例如腹泻、腹痛和呕吐的观察结果一致。但是,通过胃进行感染所需的剂量比通过鼻子感染所需的SARS-CoV-2剂量高10倍。
使用此小鼠模型的进一步研究可能会揭示出新冠病毒如何侵入大脑,以及该病毒如何在胃肠道环境中生存并侵入呼吸道。
编译/前瞻经济学人APP资讯组
原文来源:https://medicalxpress.com/news/2020-05-mouse-mimics-sars-cov-infection-humans.html
https://www.sciencedirect.com/science/article/pii/S1931312820303024?via%3Dihub
广告、内容合作请点这里:寻求合作
咨询·服务
