维立志博,追“月亮”的人
作者|陈晨 来源|医曜
“大多数人所成为的,并非是他们想成为的人,而是不得不成为的人。”这其实亦是中国创新药产业的真实写照。
维立志博IPO时的火爆,让很多投资者认为这是一家创新药领域的“超新星”。但实际上,维立志博早在2012年就已经成立,算得上是与康方生物、信达生物、君实生物等站在同一起跑线的老牌创新药企。往日对手早已成为中国创新药中坚力量之时,维立志博才姗姗来迟登陆资本市场。并不是维立志博做得不够好,而是它执着坚守自己信念中的“月亮”。
十多年前,PD-1靶点被认为是兵家必争之地,信达、君实等都果断押注这个方向,并成了行业里的 “明星公司”。面对PD-1这个“六便士”,维立志博并没有选择妥协,而是坚持了自己心中的方向。维立志博创始人康小强曾提到,2014 年回国调研时发现,已有二三十家企业扎堆 PD- 1,“市场不需要我们重复劳动”。
因此,维立志博没有去做PD-1,而是选择去解决PD-1没有解决的问题。众所周知,PD-1响应率较低,有80%左右的患者对其没有响应,这背后存在庞大的市场需求,但却又是一条无人走过的荆棘之路。艰难前行十三载,维立志博依然颗粒无收,这无疑就是坚守“月亮”的代价。
但维立志博是幸运的,赶上了生物制药的回暖。冲刺上市之际,资本市场相当狂热,3029倍认购倍数、3400 亿港元冻结资金,创下近3年港股生物科技板块 IPO 之最。资本市场用真金白银投票,这是对维立志博“不跟风”的最大褒奖。
“不跟风”的选择,透露出维立志博心中的志向。可“月亮”是无法吃饱饭的,尤其是登陆资本市场后,更是需要直面市场“六便士”的考验。维立志博还会坚定当初的理想吗?
一
“硬骨头”难啃
PD-L1/4-1BB双抗LBL-024,正是维立志博当年坚守的“月亮”。在PD-1单抗竞争激烈的今天,PD-L1/4-1BB双抗依然是一块“难啃的硬骨头”。
一直以来,4-1BB靶点的研发并不顺利,全球也尚无靶向4-1BB上市药物。这一靶点最早于1989年由百时美施贵宝(BMS)发现,近四十年的研发历程中,因4-1BB的广泛表达,过度激活机体T细胞则会带来潜在的肝毒性和全身免疫反应,众多药企折戟沉沙。而LBL-024作为全球首款进入关键注册临床阶段的4-1BB靶向药物,正试图打破这一僵局。
第一代4-1BB激动剂是BMS开发的Urelumab,但在临床中因肝毒性造成两名受试死亡,研发以失败告终。后续,辉瑞又开发了第二代4-1BB激动剂utomilumab,虽然控制住了严重的毒性,但无论单药还是联合利妥昔的疗效都非常有限,也没能逃脱失败的命运。
这样的情况下,药企纷纷将目光投向了4-1BB双抗研发,其中热度最高就是PD-L1/4-1BB双抗,其有望通过“踩刹车加油”的复合机制,提升肿瘤杀伤效果。但在这条路上不少药企也失败了。去年,由于安全性问题施维雅终止了与合作伙伴研发PD-1/4-1BB。无独有偶,基因泰克的GEN1046也被BioNTech退货。
这条布满荆棘的赛道中,维立志博正在艰难前行。LBL-024采用对称分子设计,核心特点是对PD-L1的亲和力远高于4-1BB,仅在结合肿瘤细胞表面的PD-L1后才会激活4-1BB的激动活性,以此减少其与外周血等正常组织中4-1BB的相互作用,解决4-1BB激动剂肝毒性和治疗窗口窄的挑战。
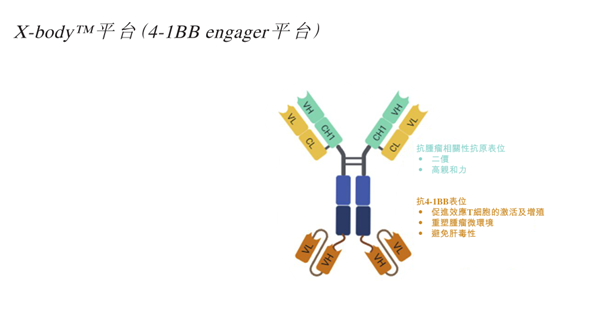
图:LBL-024结构图,来源:招股书
在适应症的选择上,维立志博选择了肺外神经内分泌癌(EP-NEC)这一小适应症为切入口,以便能通过单臂临床试验快速切入市场,后续再不断将适应症拓展到大癌种。
此前的研发日上,维立志博也更新了LBL-024联合化疗一线治疗EP-NEC的临床结果:52名疗效可评估的患者的ORR为75.0%,DCR为92.3%。15mg/kg剂量组的ORR达83.3%,这一结果优于目前所有的治疗方案。尤其在安全性这一重点问题上,入组约450名患者无一例出现剂量限制性毒性,三级及以上肝酶升高仅1.3%,与PD-1相当。这也给4-1BB的成药带来了新的希望。
基于这一临床数据,维立志博计划将在2026年提交LBL-024的上市申请。如果一切顺利的话,其有望成为全球第一个上市的4-1BB激动剂药物,也将使4-1BB成为PD-1/L1、CTLA-4、LAG3后,全球第四个成药的免疫检查点。
不过,对于PD-L1/4-1BB双抗而言,如果不能拿下肺癌、肝癌这样的主流战场,那么市场天花板将会严重受限。这也是维立志博正在做的,其表示针对LBL-024已布局12个适应症,覆盖10大癌种。

图:LBL-024临床计划,来源:公司公告
即使LBL-024成功上市,可小适应症的商业化前景有限,其后续仍有很长的路要走。“月亮”还是儿时的圆。
二
TCE,“新的月亮”
除PD-L1双抗外,维立志博还布局了ADC、TCE等热门赛道。纵观维立志博的管线布局,“不跟风” 是最鲜明的标签,没扎堆热门靶点,反而在多个领域跑到了全球前列,尤其是 TCE 平台的两款药物,潜力让人眼前一亮。
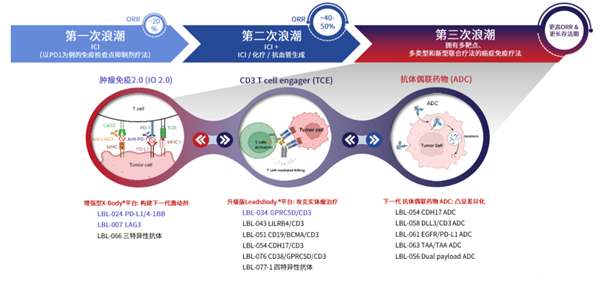
图:维立志博管线布局,来源:公司公告
基于TCE平台,维立志博研发了GPRC5D/CD3双抗LBL-034,其研发进度全球第二,仅次于强生的塔奎妥单抗。作为GPRC5D/CD3 TCE双抗,LBL-034的研发依托于维立志博的TCE平台。
从现有的临床数据来看,LBL-034确实有BIC的潜力。在治疗复发/难治性多发性骨髓瘤的临床研究中,剂量为800μg/kg时,ORR 90.9%,深度缓解(≥VGPR)81.8%,完全缓解/严格意义的完全缓解(CR/sCR)63.6%,表现优于塔奎妥单抗,做出了堪比CAR-T的疗效。
如果LBL-034在三期临床中能够稳住这个数据,意味着它能用更常规的双抗疗法,达到接近 CAR-T的疗效。这背后的想象空间可不小,毕竟 CAR-T 治疗成本高、门槛也高,双抗若能实现类似效果,对患者和市场都是大突破。
维立志博的TCE平台另一款潜在药物是LBL-043,这是一款LILRB4/CD3双抗,能够重新定向T细胞对抗AML及复发性及难治性多发性骨髓瘤细胞。
不过,多发性骨髓瘤领域可谓强者辈出。前面有强生这座大山,作为血液瘤领域的霸主,强生不仅有塔奎妥单抗,还手握达雷妥尤单抗、特立妥双抗、西达基奥仑赛 CAR-T 等产品,甚至 CD3/BCMA/GPRC5D 三抗已进入三期临床,进度远超维立志博。
后有信达生物紧追不舍,虽然其DLL3/CD3双抗 IBI115 进度落后一些,但信达推进临床的速度在行业内出了名的快,随时可能追上来。这样的情况下,维立志博不能大意,最稳妥的还是尽快找一个强大的合作伙伴,补全商业化和研发推进的短板。
血液瘤之外,维立志博还把目光投向了更广阔的实体瘤市场,LBL-033 就是先遣队员。这是全球第二款进入临床阶段的MUC16/CD3双特异性抗体,正被开发用于治疗MUC16高表达的实体瘤,尤其是卵巢癌、宫颈癌及子宫内膜癌等妇科癌症。目前I/II期临床试验数据中已观察到LBL-033的初步疗效信号及良好的耐受性。只是具体数据还没披露,后续表现值得期待。
总体来看,维立志博的管线并不是跟风凑数,而是真的在某些领域跑到了全球前面,但走一条少有人走的路必然要承担更大风险。全球领先的进度意味着没有太多先例可参考,临床推进、疗效验证都要自己摸索。这样的情况下,维立志博想把潜力变成实力还有不少难关要闯。
三
市场终归需要“六便士”
从创立至今,维立志博始终保持一颗追逐“月亮”的心,时至今日依然未变。
在研发日上,维立志博透露,公司的目标是到2030年推出3款商业化产品,4-8款临床后期产品,5个产品进入全球多中心临床,其中至少2款产品推进至全球多中心III期注册研究。
以潜力而论,维立志博的产品从不需要投资者担心,但能否顺利落地又是另外一个问题了。尤其是真正的“烧钱”时刻才刚刚到来,维立志博即将迎来现金流“大考”。
维立志博已经开始给核心产品 LBL-024拓展能力圈,在非小细胞肺癌、胆道癌、肝细胞癌等大适应症上全面铺开临床。研发开支自然水涨船高,上半年公司研发投入1.32亿元,同比增长56.92%。好在,港股成功上市为维立志博送来了“及时雨”。截至8月份,公司持有现金加上IPO募资净额,合计约16亿元,暂时能抗住眼前的研发压力。
事实上,维立志博在“找钱”这件事上一直很懂节奏:2021年市场转折前,果断将C轮融资额翻倍;今年趁市场回暖,又将IPO募资额大幅提升近一倍至1.89亿美元。正是这几次关键决策,帮它稳稳熬过了行业周期。
不过,16亿想撑住十几款新药的长期开发,公司面对的未来资金压力不容小觑。光靠资本市场输血远远不够,“抱紧大腿”通过BD合作获取资源与现金流,几乎是一条必由之路。
今年10月,在国产创新药BD大潮中,维立志博也身在其中,与美国药企Dianthus 签署就LBL-047开展合作。这次BD金额拿到台面上来说的确不算大,首付款及近期里程碑付款最高3800万美元约合2.7亿元,但至少可以覆盖掉维立志博一年的研发费用。
总体而言,维立志博能被资本市场超3000倍认购,说明大家还是认它的技术潜力。可医药行业终究要回归“临床效果好不好、能不能卖出去”的硬检验,这对熬了13年才上市的维立志博来说,才是关键一役。
企业可以坚守“月亮”,但市场终归需要“六便士”。
编者按:本文转载自微信公众号:医曜,作者:陈晨
广告、内容合作请点这里:寻求合作
咨询·服务

