“减肥神药”卖爆,全球缺货!跨国药企去年吸金超百亿美元,中国专利存争议
作者|杜苏敏、邓宇晨 来源|时代周报(ID:timeweekly)
6月3日,国家药监局药审中心(CDE)官网显示,全球胰岛素巨头诺和诺德(NVO.NYSE)的司美格鲁肽注射液(Ozempic,中文商品名为诺和泰)的新适应证上市申请已获得受理。
外界普遍推测此次申报的是“减肥适应症”,即作为低卡路里饮食和增加体力活动的辅助治疗用于初始体重指数BMI≥30kg/㎡(肥胖),或27kg/㎡≤BMI<30kg/㎡(超重)并且伴有至少一种与超重相关合并症的成人患者。
 △ 图片来源:诺和诺德
△ 图片来源:诺和诺德
时代周报记者从业内人士处了解到,一款新药的上市申请从获受理到正式获批要近2年的时间,而对于新增适应症的产品,审批时间有望缩短一半。也就是说,如果一切顺利的话,可用来减重的司美格鲁肽注射液最快一年内就能在国内获批上市。
不过,该适应症对适用人群仍然有着严格的要求,首先为成人患者,且患者的初始体重指数要≥27kg/㎡。这意味着,健康人士单纯出于减肥目的使用司美格鲁肽注射液,仍属于超适应症范畴。
然而,因减肥效果更好、副作用更小,近年来,司美格鲁肽已风靡富豪圈和明星圈,特斯拉创始人埃隆·马斯克曾自爆使用司美格鲁肽一月瘦了18斤。由此,司美格鲁肽已被冠上“减肥神药”的称号。超高的热度和广阔的市场前景也助长了国内外药企的热情,GLP-1靶点药物成为近年糖尿病和医美赛道的研发热点。
“这个靶点实在太火,也有很硬的逻辑存在,会成为爆款。”6月5日,在上市药企从事GLP-1药物研发的李鸣(化名)告诉时代周报。
目前,诺和诺德原研的初代产品利拉鲁肽已过专利保护期,多家国内药企已入局研发。由华东医药(000963.SZ)生产的首款国产利拉鲁肽注射液已于2023年上市。此外,司美格鲁肽化合物的中国专利期限也将于2026年到期(2022年其中国专利被判无效),这无疑刺激了更多企业入局。
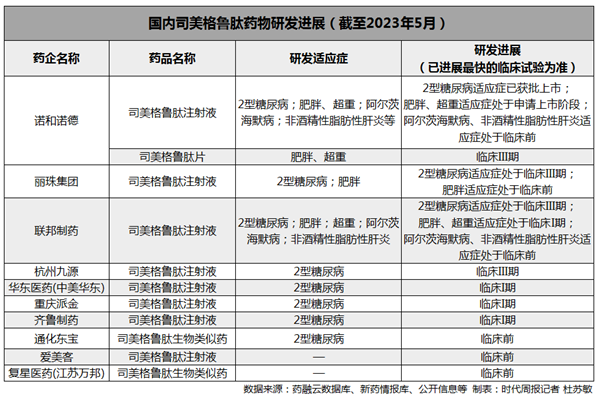
据时代周报不完全统计,除了华东医药外,包括信达生物(01801.HK)、恒瑞医药(600276.SH)、通化东宝(600867.SH)翰宇药业(300199.SZ)、众生药业(002317.SZ)、丽珠集团(000513.SZ)、联邦制药(3933.HK)等多家企业纷纷展开了以GLP-1为靶点的仿制药或创新药研发。
一
司美格鲁肽陷产能困境
目前,诺和诺德旗下共有3款司美格鲁肽药物获得FDA批准,分别是降糖药司美格鲁肽注射液Ozempic、口服降糖药司美格鲁肽片Rybelsus、减肥药司美格鲁肽注射液Wegovy。
2021年4月,司美格鲁肽注射液Ozempic首次在中国获批上市,对应适应症为用于改善2型糖尿病患者的血糖控制,剂型分别为1.5ml和3ml,两款规格均为1.34mg/ml。同年6月,规格为2.4mg/0.75ml的司美格鲁肽注射液Wegovy在美国获批用于成人肥胖症,成为全球首个用于体重管理的GLP-1受体激动剂。
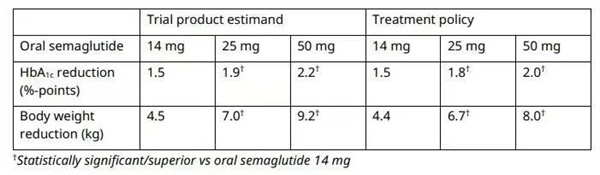 △ Rybelsus的IIIb期研究结果,图片来源:诺和诺德官网
△ Rybelsus的IIIb期研究结果,图片来源:诺和诺德官网
相较于初代产品利拉鲁肽需要每天注射,司美格鲁肽一周注射一次且效果更好,因而让GLP-1受体激动剂实现了真正的市场爆发。
2022年8月,有消息称司美格鲁肽注射液在中国减肥适应症的III期临床已完成。公开报道显示,该试验(CTR20202040)是一项随机、双盲、国际多中心的III期临床,旨在评估与安慰剂组相比,每周1次皮下注射的司美格鲁肽(24mg)在超重/肥胖同时患有或未患有2型糖尿病患者中的有效性和安全性。国内共入组300例患者,国际为375例。试验的主要终点为第44周时体重较基线的变化(%)和44周后达到体重减轻≥5%的患者比例。次要终点包括44周后达到体重减轻>10%,体重减轻≥15%,以及第44周时腰围、收缩压、身体功能评分与身体功能领域评分的变化等。
关于司美格鲁肽减肥适应症何时能获批的问题一直备受业内关注。国家药监局药品审评中心高级审评员张杰在首届中国糖尿病和代谢性疾病药物器械研发创新大会上被问及相关问题时曾表示:“我们会按照正常的审评程序审批,具体的获批速度不是我们能决定的,因为企业还没有正式申报。”
李鸣告诉时代周报记者,诺和诺德之前的国际多中心临床已经纳入了中国受试者,目前数据完善就可以申报了。“这个申报感觉只是走个流程,没有按照很赶的节奏去做。可能他们一方面还在缺货,另一方面是大量的超适应症使用,不愁卖。”
李鸣也认为,司美格鲁肽注射液新增适应症的审批预计一年内可以完成。“司美格鲁肽注射液前面做过审评,很多数据和糖尿病适应症是一样的,无需再复核,主要是临床数据的审核。另外,如果换了包材,可能会增加一点审核时间。”他进一步解释道。
尽管减肥适应症在多国未获批,但在“减肥”效果的加持下,司美格鲁肽系列产品销售火爆,彻底点燃了减肥药的市场需求,甚至出现了全球性的供应短缺。据报道,中国、美国、澳大利亚、欧洲等国家和地区均出现了缺货、断货的现象。
2022年4月,澳大利亚药物管理局开始不断收到来自患者及医生群体反馈的司美格鲁肽注射液短缺信息。2023年3月,欧洲药品管理局发布的官方声明也指出,诺和诺德的司美格鲁肽注射液将面临较长时间的供应短缺,并且预计这种短缺将持续一整年。欧洲药品管理局补充称,虽然对司美格鲁肽的供应将继续增加,但不确定何时才能满足市场需求。
司美格鲁肽产能问题一直困扰着诺和诺德。今年5月,诺和诺德宣布将Wegovy在美国针对新患者的起始剂量供应量减半,以应对市场供不应求的压力。
诺和诺德旗下司美格鲁肽产品的第一家合同制造商为全球CDMO龙头Catalent。但2021年10月,Catalent位于比利时布鲁塞尔的工厂因灌装线上的污染管控不当遭到FDA指控,这或许加剧了Wegovy的供应困境。同年12月诺和诺德透露,一家为GLP-1药物进行注射器灌装的合同制造商停止了交付。
随后,诺和诺德多次宣布增加投资扩建或新建其在丹麦卡伦堡、Bagsvaerd和美国克莱顿的工厂,以提升原料药的产能以及组装和包装的能力。不过,由于GLP-1受体激动剂属于多肽类型,工艺要求较高,因此司美格鲁肽全球供应紧张的问题并未解决。
今年4月,诺和诺德与第二家合同制造商签约,承诺增加Wegovy的供应,而第三家合同制造商也将在今年晚些时候开始生产司美格鲁肽产品,供应问题或将得到缓解。
二
国内上百药企围攻GLP-1赛道
“司美格鲁肽的药理机制为通过刺激肠促胰素,即GLP-1受体,进而增加胰岛素的分泌,以及抑制胰高血糖素的分泌,从而达到降糖的目的。另外,司美格鲁肽还可以作用于人体下丘脑的进食中枢,抑制食欲,减缓胃的排空,达到降低体重的作用。”广州中医药大学第一附属医院白云医院重症医学科负责人彭晓红告诉时代周报记者。
司美格鲁肽作为“减肥神药”的出圈,加之专利期限将至,直接带火了国内GLP-1药物开发赛道。在海外药企巨头加紧完善其产品体系及新适应症申报的同时,国内的大型药企乃至初创药企也都在“摩拳擦掌”。
Insight数据库显示,目前全球共有289个GLP-1受体激动剂处于临床前至批准上市阶段,其中国内为149个。从适应症来看,2型糖尿病治疗仍然是GLP-1类药物的主要研究方向,布局了减肥适应症的药物多达93个,其中也包括多家中国药企。
创新药企业众生睿创高管刘文(化名)在接受时代周报记者采访时表示,目前国内有上百家企业在针对GLP-1靶点进行开发,“我们不是做单靶点的,而是双靶点,对标的也并非司美格鲁肽,而是礼来的替尔泊肽(Tirzepatide)。目前GLP-1赛道的方向是长效化、多靶点。”据刘文透露,目前公司的GLP-1药物已进入临床阶段,投入的研发经费“已经有几千万元了”。
据摩根士丹利估算,到2030年,肥胖药物的市场规模预计超过540亿美元(合约人民币3848亿元),有望超过PD-1/PD-L1成为全球市场规模最大的品类。同样正在开发GLP-1靶点的口服减肥药的辉瑞制药(PFE.NYSE)则预测,在不到十年的时间内,GLP-1药物总市场规模可能接近1000亿美元,成为新一代“药王”。
而在GLP-1药物的赛道上,则呈现出“双雄争霸,巨头环伺”的局面。诺和诺德和礼来两大国际药企处于无可争议的第一梯队。
据药智全球畅销药品销售数据库,诺和诺德研发的司美格鲁肽系列药物在2022年实现销售额109亿美元,与2021年的61亿美元相比,增幅高达78%,成为了首个年销售额破百亿美元的GLP-1类药物,在全球畅销药品中排名第七。另一家药企巨头礼来(LLY.NYSE)的GLP-1R药品度拉糖肽则在2022年斩获74亿美元(约合人民币527.34亿元)。
5月4日,诺和诺德发布的2023年一季度财报显示,报告期内,司美格鲁肽三个剂型合计贡献了42.4亿美元。其中,降糖药司美格鲁肽注射液Ozempic销售额为29.1亿美元;口服降糖药司美格鲁肽片Rybelsus销售额为6.5亿美元;减肥药司美格鲁肽注射液Wegovy销售额为6.7亿美元。
而诺和诺德的口服版减肥药司美格鲁肽片更是备受市场关注,近期其临床试验也迎来了新进展。5月22日,诺和诺德公布了司美格鲁肽50mg片剂的OASIS1三期临床研究数据。数据显示,患者的平均基线体重为105.4kg,50mg组患者的体重减轻17.4%。
“我们对GLP-1类药物充满信心。我们是GLP-1领域的先行者和领导者,将继续引领创新突破,造福糖尿病、乃至更多疾病领域的患者。”诺和诺德相关负责人告诉时代周报记者。
诺和诺德的“老对手”礼来也于2022年9月在国内申报旗下产品替尔泊肽上市,用于在饮食控制和运动基础上改善成人2型糖尿病患者的血糖控制。
三
“新贵”挑战“旧王”
在国内药企中,华东医药可谓是对GLP-1赛道进攻态势最猛的一个。
2023年3月,华东医药曾发布公告称,由子公司中美华东申报的利拉鲁肽注射液“适用于成人2型糖尿病患者控制血糖”的上市许可申请获得批准,商品名为利鲁平,成为国内首个率先抢滩利拉鲁肽市场的药企。据时代周报记者梳理,复星医药(600196.SH)旗下江苏万邦、爱美客(300896.SZ)等在研的利拉鲁肽生物类似药已处于临床阶段。
据华东医药官方公众号,2023年5月,华东医药举办了“利鲁平”利拉鲁肽注射液上市发布会,并邀请多家连锁药店负责人参会。中美华东院外事业部总监代阳在会上表示,目前公司院外团队近800人,院外销售规模、核心产品的终端覆盖率正稳步提升,将一以贯之加大院外市场布局力度。据媒体报道,中美华东的利拉鲁肽注射液还在阿里健康和京东健康线上首发。时代周报记者检索发现,3ml/支的利鲁平最低价为199元/盒,同剂量由诺和诺德出品的诺和力最低价约为260元/盒。
从上述举动可以看出,华东医药正在发力利鲁平的线上线下全渠道铺设。
而华东医药的野心也远不止降糖市场。在上述会议上,浙江省中医院内分泌科主任、主任医师倪海祥在《因势利导 不止于平糖》的演讲中表示,利鲁平生产过程符合cGMP要求,海外授权,国际品质,是国内第一个利拉鲁肽生物类似药,与原研等效,有望成为第一个具有减肥适应症的降糖药。据其PPT显示,利鲁平的减肥适应症预计将于2023年底获批。
 △ 图片来源:华东医药官方公众号
△ 图片来源:华东医药官方公众号
除了利拉鲁肽外,华东医药还是首个挑战诺和诺德司美格鲁肽中国专利的国内药企。
华东医药于2021年6月10日向国家知识产权局递交司美格鲁肽专利无效申请。2022年9月5日,国家知识产权局判定司美格鲁肽核心专利(CN200680006674.6)全部无效。对此,诺和诺德在2022年财报中表示,已上诉至北京知识产权法院,后续将进入知识产权诉讼阶段。
李鸣向时代周报记者分析时表示,挑战成功的原因可能是诺和诺德关于司美格鲁肽的专利覆盖面太广,关键结构未进行充分的数据论证,被华东医药抓住了机会。此外,也有业内分析人士在接受媒体采访时指出,诺和诺德因为出于保密等考虑并未在实施例中给出具体化合物的实验结果数据,因此成为了华东医药挑战其专利的突破口。
这是否意味着诺和诺德失去了司美格鲁肽在中国的专利保护?一位从事知识产权业务的律师告诉时代周报记者,在诉讼期间专利仍处于有效状态,如果诉讼双方对判决结果不满,还可以进一步上诉至最高人民法院。诺和诺德在2022年财报中表示,其司美格鲁肽注射液在中国的专利正常于2026年到期。
目前,华东医药的司美格鲁肽注射液仿制药已进入临床I期,用于2型糖尿病患者的血糖控制。
6月1日,时代周报就利鲁平销售渠道、司美格鲁肽专利诉讼相关事宜致电华东医药董秘办并发去采访邮件,截至发稿前未收到回复。就目前双方的诉讼进展问题,诺和诺德相关负责人回复时代周报记者称“具体细节不方便评论”。
对于国内药企而言,加速抢仿司美格鲁肽是当前重点,因为弯道超车的时间窗口仅剩两年多。“我估计诺和诺德会一直纠缠下去,直到过期,毕竟还可以起诉专利局,拖一拖也就耗到过期了。此外,司美格鲁肽的减肥适应症如果批了,仿制药若走适应症拓展的方式,也就是直接证明自己与前者质量一致,不用做临床就能上市也是有可能的。”李鸣分析道。
编者按:本文转载自微信公众号:时代周报(ID:timeweekly),作者:杜苏敏 、邓宇晨
广告、内容合作请点这里:寻求合作
咨询·服务

