治疗期间延寿64.2%!中科院上海团队深挖细胞衰老清除机制,「老药新用」有效逆转小鼠衰老
作者|白州 来源|生辉(ID:SciPhi)
2013 年,发表在 Cell 上的一篇文章列举了目前已知的九大衰老机制,包括:基因组不稳定、表观遗传改变、端粒磨损、蛋白质稳态丧失、新陈代谢失调、线粒体功能障碍、细胞衰老、干细胞耗竭、细胞之间的通讯异常。

图丨衰老机制(来源:Cell)
其中,衰老细胞在体内不断累积是导致增龄相关疾病的重要因素之一。早在 2011 年,就有科学家率先利用基因工程手段处理早衰小鼠模型,从而证实,清除小鼠体内衰老细胞能够起到缓解早衰症状及延长平均寿命的作用。
该成果极大地激发了人们对于选择性清除衰老细胞药物(senolytics)开展研究的热情。近年来,研发高特异性和低毒副作用的 senolytics,已经成为抗衰老药物研究的主要方向之一。
自 2014 年加入中科院上海生命科学研究院 / 上海交通大学医学院健康科学研究所以来,孙宇带领研究小组长期聚焦于细胞衰老、机体衰老和衰老相关疾病的分子机制和药物靶向研究,并且该团队在过去几年里先后取得多项重要成果,包括原创性论文和技术专利等。
日前,该研究团队从一个自然界来源的天然药库(PDMA)中筛选了近千种天然产品,并重点研究了其中的 46 种植物提取物,最终发现葡萄籽提取物(GSE)具有独特且较强的清除衰老细胞的作用,而其组分之一原花青素 C1(PCC1)能够选择性诱导衰老细胞凋亡。研究论文已在线发表于 Nature Metabolism 期刊。

(来源:Nature Metabolism)
结合多种小鼠模型实验结果,研究团队全面揭示了 PCC1 清除小鼠体内衰老细胞、改善衰老相关疾病治疗效率并延长老年小鼠寿命的显著效果和作用机制。该研究成果表明,PCC1 或将成为新一代的抗衰老候选药物。
一
有效延长小鼠模型寿命 64.2%,死亡风险降低 35%
事实上,葡萄籽提取物(GSE)并不是一个新兴事物,也不是最近出现的新产品。作为一类自葡萄籽中提取分离得到的混合性多酚类物质,GSE 早已凭借着 “高效抗氧化剂” 的称号风靡保健品领域,受到了众多老年人和爱美人士的持续青睐。
早期研究表明,GSE 中的主要组分包括原花青素、儿茶素、表儿茶素、没食子酸、表儿茶素没食子酸酯等。其中,多种原花青素具有减少氧化损伤、抑制炎症反应、诱导肿瘤细胞凋亡等生物活性,也就是说,具有一定程度的抗氧化、抗炎症和抗癌症功效。
“此前已有研究证实, PCC1 能够诱导 DNA 损伤、引起细胞周期阻滞和检查点分子上调表达,并通过调节 BCL-2 家族成员(抗凋亡和 / 或抑凋亡亚族)、caspases 3、PARP1 等相关因子的活性变化来诱导癌细胞凋亡。”
孙宇研究员因此联想到,PCC1 有 “驾驭” 促凋亡因子的潜质,那么,该物质是否同样能够诱导衰老细胞凋亡,从而作为一种潜在的 senolycs 药物并发挥作用呢?
经过一系列多种类的细胞模型试验,研究团队发现,PCC1 能够选择性清除由不同刺激诱导的人类衰老基质细胞,并且表现出剂量依赖性。
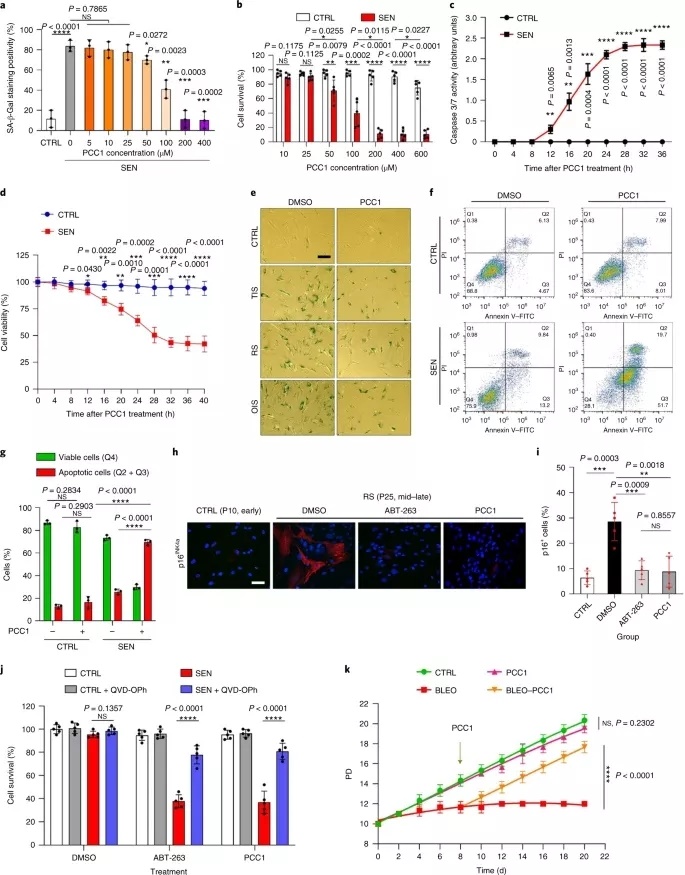
图丨 PCC1 衰老能力表征(来源:Nature Metabolism)
具体来说,在低浓度下,PCC1 可以防止衰老细胞产生衰老相关分泌表型(SASP)。当 PCC1 以更高浓度(>200 μM)使用时,其表现出去除衰老细胞的能力。并且在不超过 600 μM 的浓度范围内,对于非衰老细胞没有显著影响,因而很安全。
在组织微环境中,SASP 会对邻近细胞、周围的细胞外基质和其他结构成分产生一系列负面影响,包括慢性炎症和健康细胞的被动衰老。
根据全转录组分析结果来看,大量 SASP 因子在细胞衰老期间显著表达,但在衰老细胞经 PCC1 处理后其表达显著下降,而 Noxa、Puma 等多种促凋亡因子显著上调。
然而,一旦将衰老细胞中的 Noxa、Puma 特异性敲除,PCC1 的效果就受到显著影响。从这个角度,促凋亡因子 Noxa、Puma 在 PCC1 靶向清除衰老细胞的过程中起到了关键的作用,是两个不折不扣的 “绞杀执行者”。
“我们进而发现,PCC1 能够损害衰老细胞的线粒体功能完整性,导致线粒体膜电位显著降低,细胞色素 c 由线粒体释放到细胞质中,细胞内活性氧等自由基的含量非但没降,反而上升。” 这初步表明了 PCC1 作用背后的潜在机制。
需要强调的是,PCC1 作为原花青素家族中的一员,对增殖细胞很友好,能够增加它们的细胞活力、降低活性氧含量并减少氧化损伤,但对衰老细胞就表现为负面作用。
孙宇介绍,能够区别性对待增殖性细胞和衰老细胞,是 PCC1 作为一种新型 senolytics 药物的明显特征,使其具有相当高的抗衰老药用价值。
为了进一步测试 PCC1 的有效性及其消除衰老细胞的潜力,研究团队分别在两种不同条件导致的衰老动物模型中进行试验,包括损伤性早衰小鼠和生理性自然衰老(WT)小鼠。
其中,损伤性早衰小鼠是通过暴露于亚致死剂量(5 Gy)的全身照射(WBI)下来诱导细胞衰老,然后分别使用 PCC1 或药物载体(对照组)进行处理。
与载体注射的小鼠相比,PCC1 处理组的小鼠组织中的衰老细胞被有效消耗,并且降低了衰老标志物和一部分关键 SASP 因子的表达。宏观上看,经历过 WBI 的小鼠表现出异常的身体外观,包括明显的白色毛发、步速下降和行动迟缓。然而,经过 PCC1 的治疗在很大程度上逆转了这一系列病理情况。

(来源:Nature Metabolism)
另一方面,通过对生理性自然衰老(WT)小鼠(人类年龄大约为 75-90 岁)进行组织学评估发现,其肝脏、肾脏、肺和前列腺中均存在大量衰老细胞。
而经过每两周注射一次,持续四个月的 PCC1(或对照溶液)治疗后,接受 PCC1 的小鼠剩余健康寿命比对照组小鼠延长了 64.2%,相当于总寿命延长了 9.4%,死亡风险降低 35%(P<0.0001)。
机体体能测试结果也显示,PCC1 治疗导致了握力的提高和最大步行速度增加。与对照组小鼠相比,接受 PCC1 治疗的小鼠还具有更好的悬垂耐力、跑步机耐力、改善的平衡和提高的日常活动水平。在小鼠的肺脏等组织中 SASP 的表达显著降低,这与使用 PCC1 治疗的人类基质组织分泌 SASP 因子数量下降的结果相一致。
基于预临床试验的结果,PCC1 治疗能够有效清除小鼠体内多种组织和器官微环境中的衰老细胞。重要的是,在所有体内结果分析过程中,没有观察到小鼠的尿素、肌酐、肝酶、体重及免疫功能等受到显著影响。
除了可以靶向并消除衰老细胞之外,研究团队发现,PCC1 还具有抑制肿瘤发展的潜力。将 PCC1 单独注射到荷瘤模型小鼠体内时,它对肿瘤细胞没有影响。然而,当 PCC1 与化疗联合使用时,化疗药物对肿瘤的致死率增加了一倍,致使该方案下小鼠的存活率增加了 48.1%
总体而言,该项研究从原理上证明了 PCC1 在抗衰老领域方面的可行性。并且,即使在晚年使用其进行治疗,也将具有显著延迟年龄相关功能障碍、减少增龄相关疾病和改善健康状况的潜力,从而提供了一种延长未来老年医学患者的健康寿命和平均寿命的新途径。
二
投资机构频频下注,能否加速突破 “抗衰老” 难题?
此前,孙宇指导的肿瘤耐药课题组曾一度致力于肿瘤微环境与临床耐药方向的研究。近年来,随着细胞衰老逐渐成为国际上生命科学的重点研究领域之一,研究组又进行了独特而新颖的布局和规划,至今已获得多个国家部委等有关部门的积极关注和资金支持。
“在该项目早期,我们就注意到 GSE 体外处理可以显著改变衰老细胞的表达谱,尤其是衰老相关分泌表型(SASP),这也是该工作从一开始就充满吸引力的主要原因。”
尽管 “返老还童” 这样的字眼充满了神话色彩,但毫无疑问的是,这个人类梦想中的终极难题始终吸引着科学家们为之不懈奋斗着。

(来源:The Curious Case of Benjamin Button 剧照)
然而,抗衰老是一个多维度的技术问题,答案很可能不止一个。孙宇的答案能否成为其中之一,仍需要进一步的验证。
其中一个重要问题在于,模式动物中取得的抗衰老技术成果未必能够作用于人体,对于广大科研人员来说这无疑是巨大挑战,此前也有诸多抗衰老疗法折戟于此。
对此,孙宇分析认为,“不可否认,人类的长寿基因仍然被报道的不多,靶点至今也揭示的十分有限。但这些发现多数是从遗传学和分子生物学角度,用酵母、线虫、果蝇和小鼠等模式生物为研究工具而获得的,很多机制和规律不能直接类推到人体。我们的研究结果证实,PCC1 对多个人源细胞系均起到清除衰老细胞的作用,甚至对于原代细胞也是如此。在体外已经得到的这些数据,暗示着将来有必要向人体试验的抗衰老治疗进行大胆推进。”
对于后续如何高效且安全地上升至人体试验,孙宇也提出了自己的想法:如要在临床中验证 PCC1 这一类广谱性抗衰老化合物对人体的有效性,除了分析不同组织和器官微环境中衰老细胞变化的程度,更需要检测肝脏、肾脏甚至心脏功能的稳定性和完整性,才能客观、准确和全面地获得第一手数据,做出最有利于人类自身的科学判断。
近年以来,全球范围内不乏投资机构与投资人在抗衰老领域之中接连下注。
早在 2018 年,艾伯维携手谷歌 Calico 宣布继续投入 10 亿美元继续研究老龄化疾病;此前获得贝佐斯资助的 Altos Labs 也至少募集了 2.7 亿美元;更为具体的还包括近期刚刚募集了 1.8 亿美元风险基金的 Apollo Health Ventures,其投资公司列表中已先后囊括了 Cleara Biotech 和 Booster Therapeutics 两家致力于衰老细胞清除疗法的生物技术公司。
资本市场的活跃不仅描绘出该赛道广阔的前景,同时也在一定程度上催化了抗衰老技术的进展。
“但仅仅是注资还不够,确立具体的研究方向其实更加重要。” 孙宇表示,例如前不久赢得了广泛关注的 Altos Labs 正在以重编程技术作为主要的研究方向,一些科学家认为利用该技术可以让整个身体恢复活力,从而延长人类的终极寿命。
“针对衰老的这些治疗方式如果有效,价值当然是极高的,财富会随之滚滚而来。但显而易见的是,当前技术远远未达到这样的阶段。”
现阶段,Altos 公开表示其首个目标是 “伟大的科学”,而非获取营收。某种程度上看,提出一个响亮的口号固然吸引眼球,但事实上,这可能也是基于当前技术阶段制订的更为合理的规划。
以细胞衰老的研究为例,尽管在过去的几年中相关研究呈指数级增长,但孙宇坦率表示,实际上,有很多关键的技术问题仍然没有得到解决。
例如,人类最大寿限是否受到细胞衰老之外的未知因素影响,是否还可以在目前基础上大幅延伸?不同细胞类型的衰老细胞的特征(如端粒长度和缩短速率)并不相同,这究竟取决于什么?即使是同一类型的细胞,由于其衰老诱导方式不同,生物学表型也不完全一样。在临床试验中,不同遗传背景(包括家族遗传成分)的人类的衰老细胞差异,是否会对其寿命造成显著影响?
种种变量和差异,为衰老细胞 “量身定做” senolytics 疗法设置了重重障碍。孙宇认为,抗衰老领域的研究仍然存在很多未知和变数。人类究竟能在这条道路上走多远?是否真正可以驾驭 “积重难返” 的生理规则和自然定律?我们不妨拭目以待。
参考资料:
https://www.nature.com/articles/s42255-021-00491-8
https://www.nature.com/articles/nature10600?message-global=remove&page=2
编者按:本文转载自微信公众号:生辉(ID:SciPhi),作者:白州
广告、内容合作请点这里:寻求合作
咨询·服务

