苏州大学黄建安/刘泽毅团队揭示PD-L1入核后促进肺癌的新机制
图源:摄图网
作者|学术君 来源|学术观察(ID:gh_7759ccd6957e)
肺癌是发病率和死亡率较高的恶性肿瘤之一,严重威胁着人类的健康。传统手术、放化疗等治疗手段起效的同时,复发、转移以及副作用接踵而来,人们期待更具优势的治疗手段出现。
近年来,以程序性死亡受体1(PD-1)/程序性死亡配体1(PD-L1)为靶点的免疫治疗发展迅速,已成为肿瘤治疗领域的研究热点。
PD-L1 分子是 B7 协同刺激分子超家族的重要成员,其经典作用是可以通过受体 PD-1 传递抑制性信号使肿瘤局部微环境 T 细胞免疫效应降低,介导肿瘤免疫逃逸,促进肿瘤生长。
虽然 PD-L1 分子可作为肿瘤免疫治疗的有效靶点,但有一部分病人并不能从该分子的免疫治疗中获益,5年生存率没有显著改善。后续研究揭示了该分子可以不依赖机体免疫系统,单独作为膜蛋白通过激活一系列肿瘤内源信号通路在多种肿瘤的增殖、转移、耐药、糖酵解等生物学过程中发挥着重要调控作用。
PD-L1主要表达在细胞膜和细胞浆中,但在某些特殊情况下也可以进入细胞核。研究证实核PD-L1表达与肿瘤细胞耐药及病人不良预后密切相关。而最新 Cell Research、Nature Cell Biology 研究也报道核PD-L1可以转录调控下游靶基因表达并与肿瘤细胞焦亡、免疫疗效相关。
因此研究核PD-L1分子在肿瘤发生发展中的功能及潜在机制已成为了当前肿瘤研究热点和难点,但在肺癌中目前尚无任何研究报道。
近日,苏州大学附属第一医院呼吸与危重症医学科黄建安和刘泽毅教授团队在 Cell Death & Differentiation (IF=10.7)杂志上发表题为:KPNB1-mediated nuclear translocation of PD-L1 promotes non-small cell lung cancer cell proliferation via the Gas6/MerTK signaling pathway 的最新研究论文。
该研究揭示了PD-L1分子入核通过激活Gas6/MerTK信号通路进而促进非小细胞肺癌细胞增殖的机制,不仅有助于阐明 PD-L1 分子的新功能,更有可能为肺癌免疫治疗的优化提供新的视角。

研究内容
研究人员首先发现,干扰PD-L1表达非小细胞肺癌细胞增殖能力显著减弱。为了明确潜在机制,研究者通过蛋白芯片发现干扰PD-L1 表达可降低受体络氨酸激酶家族 MerTK 的活化,而过表达PD-L1后MerTK活化明显增强,提示PD-L1 表达可影响 MerTK信号通路的激活(图1)。
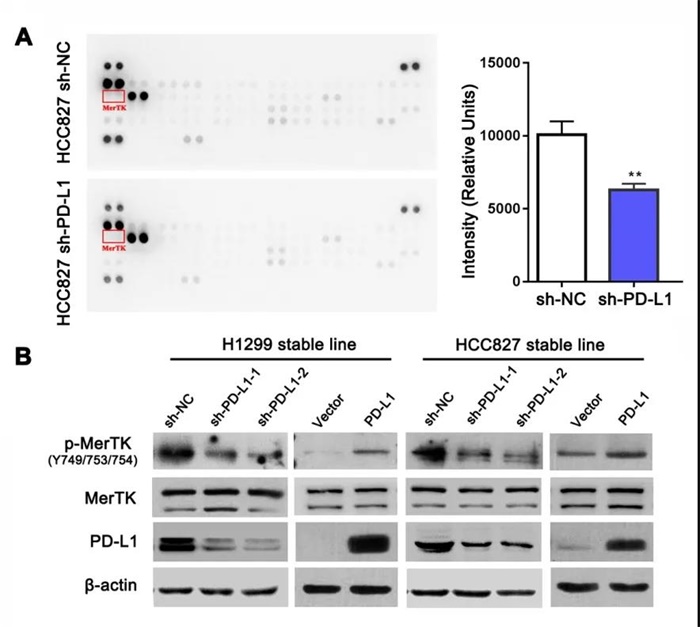
图1 肺癌细胞中干扰PD-L1分子可影响p-MerTK的表达
蛋白质分子的亚细胞定位是蛋白发挥功能的重要体现。为了明确PD-L1如何激活肿瘤内源信号 MerTK通路,作者首先证实在NSCLC细胞株中存在核PD-L1的表达。接下来,作者进一步探究了PD-L1入核的分子机制。通过蛋白质质谱技术、蛋白核质分离分析发现干扰KPNB1表达后,PD-L1入核减少;而过表达KPNB1则可促进PD-L1入核,导致核 PD-L1 表达增加。上述结果揭示我们KPNB1 可协助 PD-L1 发生核转位过程(图2)。
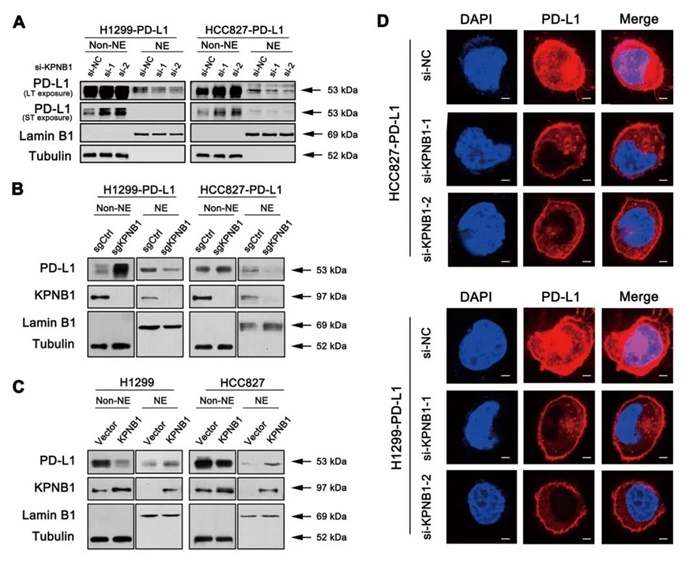
图2 肺癌细胞中干扰KPNB1可影响核PD-L1的表达
PD-L1入核后如何调控Gas6/MerTK通路呢?
MerTK活化的主要方式是通过与配体Gas6或者PROS1 结合。目前尚无研究证实PD-L1可作为单独的转录因子调控靶基因的表达,那么核PD-L1是否可作为转录共活化因子通过结合其他转录因子促进Gas6的转录及表达。为了验证该猜想,作者通过ChIP、双荧光素酶报告载体、野生型和突变型质粒构建等方法证实PD-L1可以与转录因子Sp1协同作用促进Gas6转录(图3)。
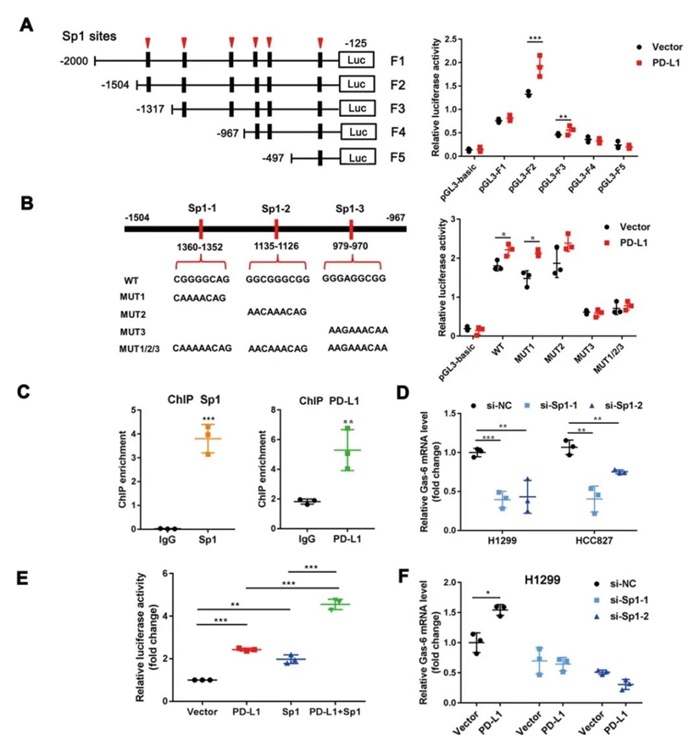
图3 肺癌细胞中PD-L1与Sp1协同作用促进Gas6转录
文章总结
在肺癌中 PD-L1 高表达,高表达的PD-L1通过与入核蛋白KPNB1相结合进入细胞核,并与转录因子Sp1协同作用促进Gas6转录。
高表达的Gas6通过粘附在外泌体表面释放至细胞外,通过与细胞膜上的MerTK受体结合,活化 MerTK及其下游AKT、Erk信号通路,促进肿瘤细胞的增殖能力,为克服部分PD-L1高表达的肺癌患者不能从PD-1/PD-L1免疫治疗中获益提供新的治疗思路。
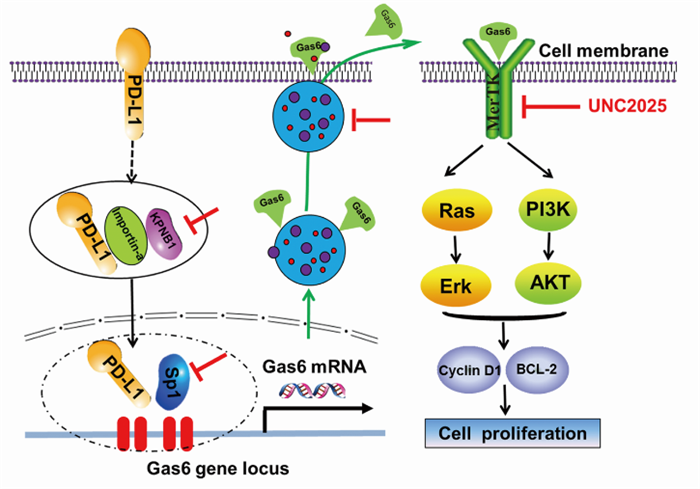
图4 肺癌细胞中 PD-L1 核转位激活 Gas6/MerTK通路的机制假说图
该研究揭示了PD-L1分子入核通过激活Gas6/MerTK信号通路进而促进非小细胞肺癌细胞增殖的机制,不仅有助于阐明 PD-L1 分子的新功能,更有可能为肺癌免疫治疗的优化提供新的视角。
论文链接:
https://www.nature.com/articles/s41418-020-00651-5
编者按:本文转载自微信公众号:学术观察(ID:gh_7759ccd6957e),作者:学术君
广告、内容合作请点这里:寻求合作
咨询·服务



