5分钟出结果!新冠病毒检测越快越好吗?
作者|全球风口 来源|全球风口(ID:haiyinwangyuquan)
截止4月1日,全球新冠肺炎确诊病例超过77万人,死亡超过3万8千人。随着疫情的发展,对新冠病毒的检测成为当前全球战“疫”的重中之重。
高效及时完成病毒检测是早发现、早隔离、早治疗的重要基础,关系到疫情的防控成效,市面上随之也出现了五花八门的检测方法和配套试剂盒,那么这些试剂盒究竟有什么不同呢?

1、怎么评价检测试剂盒的好坏?
试剂盒就是装了试剂的盒子,它本身并不能检测新冠病毒,是给检测新冠病毒的仪器设备提供检测样本用的。这些试剂盒采样后一般都需要送到相关设备里做检测才能知道结果。
试剂盒的好坏的标准:
一是灵敏度,不能太迟钝,导致感染了也检测不出来;
二是特异性,不能出现假阳性,把没感染的的也判断成感染了。
这两个是关键指标,一个检测试剂盒是否过关,主要就看这些指标。
2、为什么有的检测需要1天,有的最快2分钟出结果?
目前,市面上的新冠病毒检测试剂盒主要有两种:1、核酸检测试剂;2、抗体检测试剂。分别属于体外诊断市场中的分子诊断和免疫诊断。
需要注意的是,人体感染新冠后,可以检测到核酸和抗体的时间是不一样的。理论上,感染后1-2天即可检测到核酸; 7-14天左右可检测到IgM(抗体); 21天左右可检测到IgG(抗体)。有些免疫功能较弱的病人可能抗体量很低,容易造成假阴性。而在感染之初,病原体抗原含量也较低,同样不容易检测到。所以抗体检测不能作为排除感染的依据。
相比之下,新冠病毒核酸检测可以做到早发现、早隔离、早治疗,所以是检测排查的主流方法。对于已经有症状的人,抗体检测可以帮助他们快速确诊。

目前已经批准的新冠核酸检测产品:
1、新冠核酸检测试剂盒(荧光PCR法): 检测新冠病毒的特异性靶基因,一般2-3小时完成
2、新冠核酸检测试剂盒(恒温扩增-实时荧光法) :检测新冠病毒的特异性靶基因,在同一温度下扩增,相对于荧光PCR法,对设备要求更低,一般1-2小时完成。
3、新冠核酸检测试剂盒(杂交捕获免疫荧光法) :检测新冠病毒的特异性靶基因,配套检测设备体积小,单个样本的检测时长更短,一般大约1小时。
4、新冠核酸检测试剂盒(RNA捕获探针法) :检测新冠病毒的特异性靶基因,有效减少污染,操作简便,可连续检测,一般约1.5小时完成。
5、六项呼吸道病毒核酸检测试剂盒(恒温扩增芯片法)及配套仪器 :可同时检测新冠病毒、甲型流感病毒、H1N1流感病毒、甲型H3N2流感病毒、乙型流感病毒、呼吸道合胞病毒。一般1.5小时。
6、新冠核酸检测试剂盒(联合探针锚定聚合测序法)及仪器和软件 :全基因组序列测定,准确率可达100%,但是成本较高、操作复杂,不适用于临床常规检测。一般22小时。
另外,多数新冠核酸检测都可以并行批量检测100-200份。
目前已经批准的新冠抗体检测产品:
1、新冠抗体检测试剂盒(胶体金法)
-检测lgM抗体
-检测并区分lgM/lgG抗体
-检测但不区分lgM/lgG抗体。
特点:类似血糖仪试纸一样,可目视判读,进行早期感染和既往感染的辅助诊断,无需检测设备,适用于大范围快速筛查。操作简单,但是灵敏度低,一般2-10分钟出结果。

2、新冠抗体检测试剂盒(磁微粒化学发光法)
-检测总抗体
-检测lgM抗体
-检测lgG抗体
特点:高灵敏度,高特异性,重复性好,全自动程度高。但是需要专门的化学发光检测设备,可批量检测200份,一般30分钟出结果。
3、新冠抗体检测试剂盒(酶联免疫法)
-检测lgM抗体
-检测lgG抗体
特点:酶联免疫法简便、快速、灵敏度高,使用酶标分析仪判读结果,适用于大范围筛查,提供血清学证据。可以批量检测200份,一般1小时出结果。
此前,中国的胶体金法新冠抗体检测试剂盒已经有6家公司的产品被国家药监局批准上市,投入使用,可以最快在2分钟检测出新冠病毒抗体。
美国时间3月31日,美国FDA紧急批准的来自Bodysphere的新冠病毒检测试剂盒,最快能够在2分钟内检测出和新冠病毒相关的抗体,也是采用的抗体检测法。
但是正如前面介绍,由于抗体产生需要时间,一般几天至几周不等,有些免疫功能较弱的病人可能抗体量很低,容易造成假阴性,抗体检测可用于病例的辅助诊断,但是还不能代替核酸检测方法。
无症状者或轻症者体内浓度低,如果一味追求反应快,可能会造成漏检。目前各个医疗机构都有大量样本,最需要的是高通量核酸检测解决方案,也就是一次可以并行检测成百上千个样本,短时间内达到大量样本检测的目的。
3、检测越快就是越好么?

近期大火的美国雅培5分钟新冠病毒检测仪刷屏了。美国时间3月27日,雅培公司宣布该公司的便携式新冠病毒检测仪获得了FDA批准,通过寻找新冠病毒基因组的碎片来诊断,当碎片浓度较高时,仅需5分钟就能检出,彻底搜索得到阴性结果需要13分钟。
乍一看,感觉是大突破,但是仔细分析就会发现一些隐藏的细节。雅培公司便携式设备的好处是小巧方便,非常适合小诊所。
缺点是低通量和灵敏度差。1次仅能检测1个样本,按照单个样本检测时长5分钟并没有优势,因为以往的新冠核酸检测方法采用的是高通量,一次就可以检测上百份样本,算下来平均下来1个样本出结果的时间才5秒钟。
灵敏度方面不可忽视,华大基因执行总裁尹烨提到:“一般的核酸检测需要先灭活(这个环节就需要30分钟),为了提高准确度,需要对核酸提取纯化,再循环经历扩增所需的变性、退火等等步骤多次,才能检测出结果,这是导致诊断时间偏长的主要因素。这样的方法检测到的灵敏度会很高,即使100copy/mL的病毒载量通过扩增也可被检出,假阳性率较低,所以获得了WHO、FDA、以及中国卫健委等权威的认可,作为新冠病毒确诊的金标准。
雅培提出的快速检测方法为了追求减少时间,在循环扩增等环节会大大缩水,灵敏度自然大打折扣,5分钟能够检出的,需要等到病毒的载量达到5000copy/mL甚至更高才能检出感染,这个时候病人已经被感染好多天,漏检率会升高。”
检测成本方面,快速检测因为通量小,仪器和试剂的成本往往会达到RT-PCR检测的5倍以上。对于大规模检测来说并不合算。
4、中国获批上市的新冠病毒检测试剂盒有哪些?
目前,国家药监局已经应急批准23个新型冠状病毒检测产品,其中新冠病毒核酸检测试剂15个,抗体检测试剂8个。涉及上市公司包括华大基因、海特生物、明德生物、达安基因、万孚生物、迈克生物、丽珠集团等。
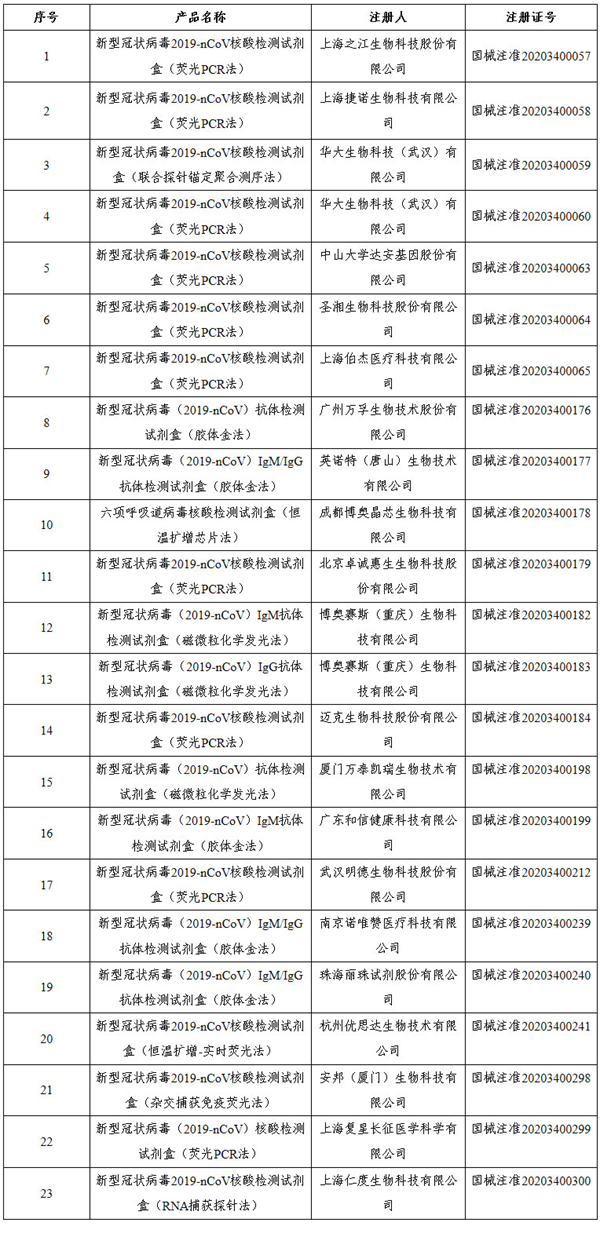
表1 国家药监局批准的23个新冠病毒检测试剂盒
5、中国试剂盒出海为何风波不断?
随着新冠肺炎疫情在全球蔓延,新冠病毒检测试剂盒的需求量明显增多。检测成为控制疫情的关键。在海外多国疫情大流行、试剂盒短缺情况下,不少中国试剂盒企业开始探寻出海之路。
其中,美康生物、硕世生物、凯普生物、安科生物、达安基因、万孚生物、迈克生物等至少9家上市公司取得了欧盟 CE 认证。
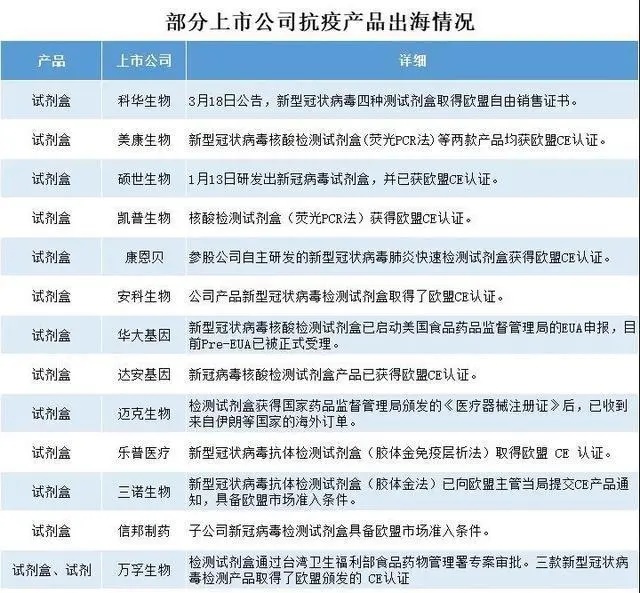
相比欧盟CE认证而言,美国市场的准入门槛更高。
3月27日,华大基因的新型冠状病毒核酸检测试剂盒获得美国FDA紧急使用授权,是国内首个获得该授权的企业,有助于为美国提供高质量、大批量的检测服务,辅助新冠病毒感染者筛查,从而防止感染的进一步扩散。
出口试剂盒质量不合格? 西班牙买到假货?
西班牙《国家报》3月26日报道,西班牙从中国购买的深圳市易瑞生物技术股份有限公司检测试剂盒只有30%的敏感度,远低于80%的预期。
仔细看你会发现,易瑞生物的检测产品并未获得中国国家药监局的官方销售许可,不在国家药监局批准的23个新冠病毒检测试剂盒名单中(表1),相关产品也并没在国内销售。
国内已有近140家企业生产出了新冠病毒检测试剂盒 ,而国家药监总局仅仅批准了23家企业生产的新冠病毒检测试剂。
随着民众们的讨论度越来越高,西班牙政府发布了一份声明称:这批涉事次品试剂盒不是由西班牙政府直接从中国政府采购的,而是通过一家本国供应商从中国生产商处进口。
虽然这批货物是有欧盟CE认证,根据法律可以在欧盟销售,不过这个认证并不能保证质量。现在,西班牙已退回这批试剂盒,并联系供应商要求用其他试剂盒来替代。
新冠病毒检测试剂盒仅有欧盟CE认证,不能出口
在欧盟CE认证中,企业报批相关检测数据,并对披露信息承担责任。实际上,企业获得欧盟CE认证的难度并不高。中国国家药监局则会组织专门机构对产品进行多重检验,合格者才可获得注册证,产品才可上市销售。

近日,国家药监局发布了《关于新冠肺炎疫情防控用医疗器械出口提供相关证明的函》,要求全国各地药监局需要加强对新冠防控用品体外诊断试剂、医用防护服、医用口罩等加强相关出口产品的质量检查,需符合以下条件:
生产企业在我国取得医疗器械生产许可证书或已办理医疗器械生产备案
所生产产品在我国已取得医疗器械产品注册赠书或办理医疗器械产品备案
所以做出口或者给海外捐助医疗物资的朋友们要注意了,不能只看欧盟CE认证,一定要检查相关产品是否获得了中国药监局的许可。
6、为什么美国会缺试剂盒?
美国是公认的目前科技实力最强的国家,为什么连美国都缺试剂盒?其实,新冠病毒检测试剂盒没有特别高的技术门槛,对于美国这样有一定技术基础的国家而言研制难度并不大,而且在原材料方面,美国比中国丰富。
中国很多实验室使用的都是从美国进口的原料,例如逆转录酶(进行核酸检测的一个关键酶)。美国研制新冠病毒检测试剂盒无论在原料、设计等方面都不存在难以突破的技术性问题。
《纽约时报》称,在严峻的疫情面前,美国疾控中心仍坚持使用自研的、有缺陷的核酸试剂盒,直接导致了检测进展缓慢。美国政府早期不允许各实验室开发自己的试剂盒,也延缓了对疫情的响应。
华盛顿大学临床病毒学实验室早在2月18日就研发出检测盒,等待FDA批准,但一直没有获批,直到2月29日放宽限制。
美国赛默飞世尔和瑞士罗氏制药等大型跨国药企直到3月中旬才被美国FDA获准生产检测试剂盒。

(罗氏cobas检测系统,一次可检测384个样本,每台机器检测4000个每天)
美国赛默飞世尔和瑞士罗氏制药这两家公司带来了整套的成熟设备和核酸检测试剂盒,使用全自动高通量实时PCR仪器,并通过扩大试剂盒产能,预计每月可检测500万例。
中国试剂盒产量
早在1月31日,中国国家药品监督管理局就已应急审批7个新型冠状病毒核酸检测试剂,提升试剂产量,供应社会。2月1日,中国新型冠状病毒核酸检测试剂盒产量就已达到了77.3万份/天,是当时疑似患病者的40倍。全部释放产能,这个数量还可以提升。
根据华西证券研报称,全球每日消耗核酸检测试剂盒50万至70万只,核酸检测试剂盒短缺将成为全球化问题。
在这场全球的疫情中,如此庞大的试剂盒需求,虽然很多国家都有制造能力,但是大头恐怕还是得落在中国的肩上。我国供应链网络的强大,不仅在于规模大、种类全、物流快,更在于很多供应商企业可以短时间、大批量,用较低的成本生产出产品。目前已经有26国向中国下单新冠病毒检测试剂盒,全球订购数量超过1500万只。
王煜全
全球科技创新产业专家、海银资本创始合伙人
中国制造是对全球创新的价值实现,中国能够帮助全世界的科学家、企业家把创新变成现实。
要想合法合规地打破封锁,最终从科技大国迈向科技强国,在具体做法上,我们应做到“一个继承,两个突破”。
一个继承,指的是我们必须继承全球商业文化,必须尊重国际合作的规则,尊重知识产权,必须对创新的价值给予充分的认同,在继承的基础上去实现超越。
两个突破:一不要在现有技术上做争夺,而是要在下一轮有希望的领域取得突破;二不要在吸引大企业建厂上做争夺,而是要在吸引小企业落地上做突破(创新越来越集中在小公司)。
中国制造有优势,但创新才是突破口。制造本身不再是核心因素,制造最有科技含量的产品才是重要的。我们应当凭借前沿科技产品的制造,在创新之网上有所作为。
今天的全球竞争,早就从零和博弈的、区域替代型的竞争,变成了全球创新生态的协作型竞争。我们也应当在这种格局下去认识中国的未来。
编者按:本文转载自微信公众号:全球风口(ID:haiyinwangyuquan)
广告、内容合作请点这里:寻求合作
咨询·服务

