十张图了解2018年受理新注册申请药品情况 鼓励新药研制,化药申请数量大增
2018年,我国药审中心在鼓励药物研发创新、提高药品质量、保障人民用药安全有效可及等方面开展了一系列工作,以高度的责任感和使命感持续深化药品审评审批制度改革,坚持依法依规、科学规范审评,坚决维护和促进公众健康。2018年受理新注册申请药物大幅增长,化药、生物制品增长尤为突出。IND申请主要集中在抗肿瘤领域。
受理新注册申请增幅较大,技术审评受理大幅增长
2019年4月20日,药品管理法修订草案提交十三届全国人大常委会进行二次审议。修订草案在鼓励新药研制、加强药品生产管理、强化药价监管等方面对部分法律条文进行了修改,旨在鼓励药品创新,为人民群众健康提供安全有效的药品保障。鼓励药品创新是我国推进健康中国行动的应有之意,各大医药集团充分响应国家号召,2018年,药审中心受理新注册申请共7336件,较上年同比增长51.66%。

在2018年药审中心受理新注册申请药品中,需技术审评的注册申请大幅增加,2018年需技术审评的注册申请数达到了5574件,较上年同比增长47%,占全部受理新注册申请药品数量的75.98%。其中,需技术审评的5574件注册申请中,化学药品为4459件,占全部需技术审评的注册申请受理量的80%,中药和生物制品注册申请分别为300件和815件,分别占全部需技术审评的注册申请受理量5.4%和14.6%。

化药仿制药注册申请受理增幅较大,IND申请集中在抗肿瘤领域
随着药审中心受理新注册申请药品数量发生增长,在药品注册申请中占据主流地位的化学药品新注册申请增幅同样较大。2018年,药审中心受理化学药注册申请共5979件,较上年同比增长54.50%,略高于药品注册申请数量增速。
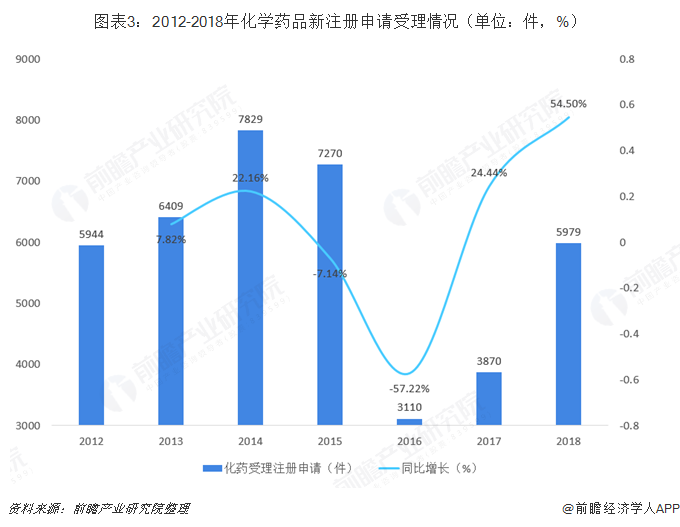
在化学药品注册申请中,除补充申请和直接行政审批外,仿制药(ANDA)注册申请数量最多,2018年受理仿制药上市申请(ANDA)982件,占全部化学药品注册申请的16.42%,较2017年增长了79%;一致性评价注册申请位居其次,申请数量为607件,占全部化学药品注册申请的10.15%。
从2018年化学药品注册申请种类结构中可以看出,仿制药一致性评价工作正在顺利推进中。药审中心起草并于2018年10月29日经国家局发布《生物等效性研究的统计学指导原则》、《高变异药物生物等效性研究技术指导原则》,建立并完善了仿制药一致性评价指导原则,完成《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》要求,药审中心不断为推进仿制药质量和疗效一致性评价进行努力。

2018年,药审中心受理化药临床(IND)新注册申请457件,其中受理国产化药IND申请325件,受理进口IND申请132件。国产化药IND申请的适应症主要集中在抗肿瘤、内分泌系统和消化系统领域,受理新申请件数分别为165件、27件和24件;进口IND申请的适应症主要集中在抗肿瘤、内分泌系统和循环系统领域,受理新申请件数分别为48件、14件和9件。

中药受理新注册申请占比较小,临床注册申请占据主流
相对于化学药和生物制药受理注册申请数量而言,中药受理新注册申请数量较少,2018年,药审中心受理中药注册申请413件,较上年同比增长23.28%,远低于药品注册申请数量增速。
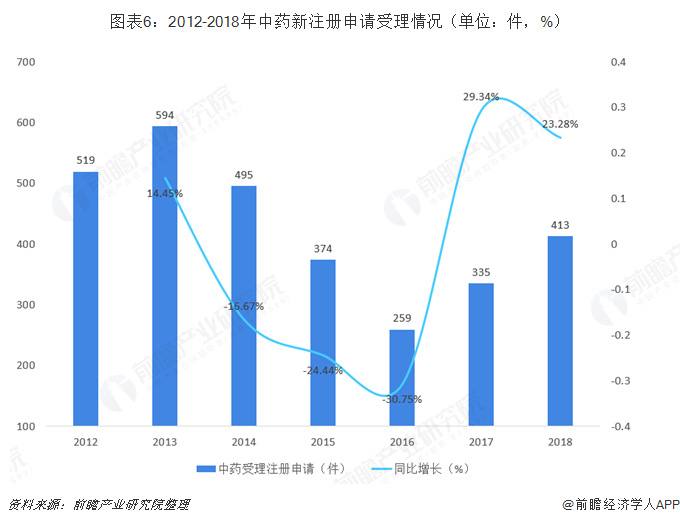
在中药注册申请中,除补充申请和直接行政审批外,临床申请(IND)注册申请数量最多,2018年受理临床申请(IND)31件,占全部中药注册申请的7.5%;新药上市(NDA)和仿制药上市(ANDA)申请数量相同,申请数量均为8件,占全部中药注册申请的1.96%。

生物制品注册申请数量激增,抗肿瘤药物成为IND申请重点领域
随着健康中国行动的不断推进,生物制品药物已经逐渐成为药品市场上崛起的新兴力量。2018年,生物制品药物受理新注册申请数量大幅增长,全年累计受理申请944件,较上年同比增长49.37%,生物制品药物受理新注册申请数量占比已由2012年的6.43%上升至2018年的12.87%;生物制品药物需技术审评占比更高,达到了14.6%。

2018年,药审中心共计受理生物制品注册申请944件,其中受理生物制品临床申请298件,受理生物制品新药上市申请85件,NDA申请较2017年涨幅70%以上。在生物制品药物注册申请领域,除补充申请和直接行政审批外,治疗用IND占据最大比重,占2018年生物制品注册审批数量的29.0%;其次为治疗用NDA,占2018年生物制品注册审批数量的7.0%。

2018年药审中心受理I类治疗用生物制品IND申请108件,涉及93个品种。与化药IND申请略有不同的是,生物制品IND申请适应症绝大部分集中在抗肿瘤治疗领域,占全部I类治疗用生物制品IND申请的70%,消化系统药物、内分泌系统药物和外科药物略有分布,但是占比较小。

以上数据及分析均来自于前瞻产业研究院《中国医药行业市场前瞻与投资战略规划分析报告》
更多深度行业分析尽在【前瞻经济学人APP】,还可以与500+经济学家/资深行业研究员交流互动。
广告、内容合作请点这里:寻求合作
咨询·服务


