从抗癌神药-利妥昔单抗类似物上市看中国生物类似药竞争格局
2019年2月22日,国家药品监督管理局批准上海复宏汉霖生物制药有限公司研制的利妥昔单抗注射液(商品名:汉利康)上市注册申请。该药是国内获批的首个生物类似药,主要用于非霍奇金淋巴瘤的治疗。
生物类似药是指在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品。中国在2015年2月制订发布了《生物类似药研发与评价技术指导原则(试行)》。目前我国已成为生物类似药在研数量最多的国家,先后有近200余个生物类似药临床试验申请获得批准,部分产品已完成Ⅲ期临床试验并提交了上市注册申请。
罗氏利妥昔销售金额下降
利妥昔单抗是全球首个治疗非霍奇金淋巴瘤单抗。作为罗氏单抗三大巨头之一,利妥昔单抗连续多年跻身全球畅销药品排行榜TOP10,虽然该产品在欧洲专利保护期已于2014年底到期,面临着生物类似药的冲击,但2015-2017年其全球销售额仍呈现稳步上升的态势,2017年实现全球销售额73.88亿瑞士法郎,同比去年增长1.21%,在2017年全球畅销药品排行榜中排位第五。根据公司披露的2018年年报来看,2018年全球销售额为67.52亿元,较上年下降9%。
而从国内目前的状况来看,罗氏的美罗华自获批进口后销售额逐年看涨,2017年顺利进入医保后放量可期。由于生物类似药研发壁垒高,罗氏多年来独占市场,随着复星医药产品获批上市,其余15家企业的产品步入赛道,利妥昔单抗国内市场格局或将改变。

美罗华(利妥昔单抗注射液)生物类似药
复宏汉霖的HLX01为美罗华生物类似药。HLX01目前就非霍奇金淋巴瘤适应症(漫大B细胞淋巴瘤、复发性或难治性滤泡中心淋巴瘤及先前未经治疗的CD20阳性III-IV期滤泡性淋巴瘤)获得国家药监局上市许可优先审评,成为中国首个根据生物类似药指导原则批准上市的生物类似药。此外,国家药典委员会已批准HLX01被列入国家医保目录及国家基本药物目录。根据资料显示,2017年,美罗华的全球销售额为74亿瑞士法郎(约75亿美元),在中国的销售额达人民币21亿元。预计2018年将达到25亿元。
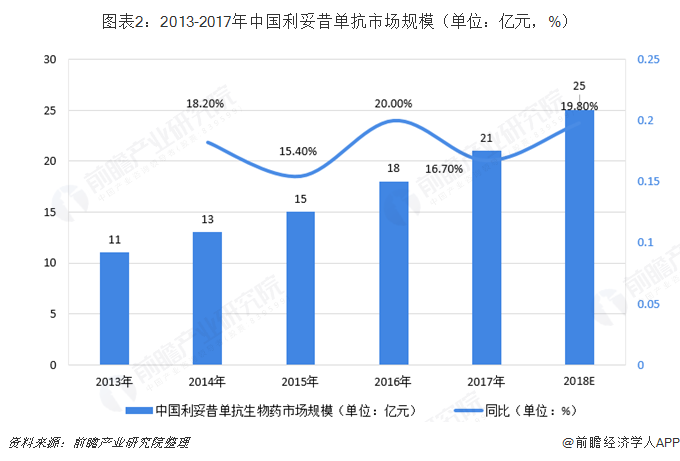
HLX01其竞争对手除了原研药厂家罗氏的美罗华,还需要面对中国的仿制药公司的竞争,类似信达生物、百济神州、丽珠医药等公司都在开发利妥昔单抗类似药,其中主要厂家都已经做到了临床三期,HLX01已经批准上市。估计2019年会上市销售,届时其他生物类似药暂未上市,估计能取得不错的成绩。
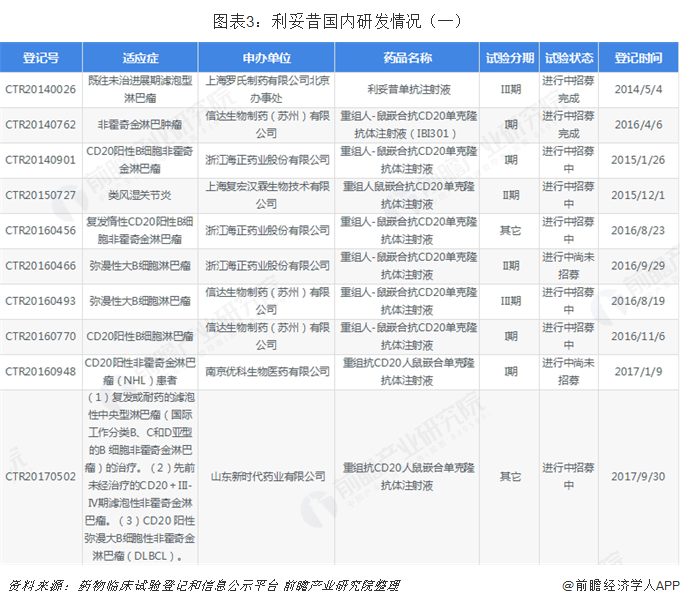

利妥昔单抗注射液国内发展前景
利妥昔单抗注射液国内发展前景在国内非常广阔。在2018年国家医保目录的更新中,很多的肿瘤治疗药物都大幅度的降价,其中罗氏的利妥昔单抗(美罗华)下降了40%,同时由于医保支付,利妥昔单抗的使用率也会逐渐提高,以前被抑制的需求将会爆发。根据前瞻产业研究院预测,未来利妥昔单抗将会逐步放量,预计到2024年规模将会达到185亿元。

以上数据来源参考前瞻产业研究院发布的《中国生物医药行业市场前瞻与投资战略规划分析报告》】
更多深度行业分析尽在【前瞻经济学人APP】,还可以与500+经济学家/资深行业研究员交流互动。
广告、内容合作请点这里:寻求合作
咨询·服务


