力争3年审批200项!北京发力了,推动药品研发成果转化【附创新药行业市场分析】
图源:摄图网
9月14日,北京市药监局近日印发《药品创新服务提质增效行动方案(2023-2025年)》的通知。该方案将有效鼓励药品研发创新,推动药品研发成果转化和产品上市。
方案提出,到今年底,北京在研药品纳入项目制管理品种数量不少于100项;启动在线咨询、重点项目跟踪服务管理模块等信息化建设。到2024年底,累计纳入项目制管理品种数量不少于200项;完成在线咨询、重点项目跟踪服务管理模块等信息化建设并上线运行。到2025年底,累计纳入项目制管理品种数量不少于300项;三年内获批药物临床试验创新药项目不少于200项。
值得一提的是,该方案的发布对于创新药的研发和上市具有重要意义,为创新药的研发提供更多机会和资源。
中国创新药新产品研发活跃,批准趋严
2020-2022年,中国批准创新药临床试验的数量有所增加,而上市批准数量则在2021年大幅上升后在2022年由于批准趋严而大幅下降。2022年,中国批准临床品种数量增加至1615件;项目上市18件,其中中药天然药物5件,化学药品9件,生物制品4件。
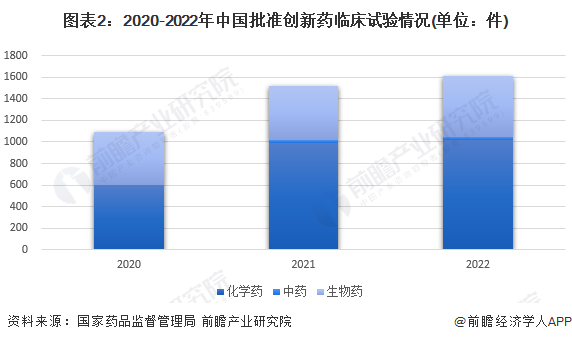

我国创新药研发趋势
随着医疗体制改革的深入,国家相继出台了以降低价格为主要导向的集中招标、药品零加价及差别定价的价格管理制度和药品流通环节价格管理的暂行办法,对列入政府定价范围的药品价格进行全面调整。对此,行业内企业要把握行业发展变化趋势,加强创新研发投入,丰富产品线,优化产品结构,提升研发效率;同时,在生产上提升规模化效益,积极降本增效;营销上逐步加大市场开拓力度,提高产品力,以扩大市场覆盖度。
从药物研发趋势来看,重点热点产品的情况如下表所示:

中国工程院院士、中国科学院上海药物研究所研究员丁健认为我国药物研究和产业发展进入创新跨越的新阶段,机遇与挑战共存。国内创新药赛道的‘内卷’已成为业内共识,在生物医药领域,急需原始创新。
蛋白质技术国家工程研究中心主任罗永章表示,无论是国家1.1类生物制品还是三类医疗器械的研发,都比较艰难。一是药物研发长路漫漫,每一个创新药物的研发,都需要十几年、几十年默默无闻、甘愿清贫地奋斗;二是创新医药产品除了研发本身,学术氛围和商业诚信要改善,科技评价体系也需要完善。
前瞻经济学人APP资讯组
更多本行业研究分析详见前瞻产业研究院《中国生物医药行业发展前景预测与投资战略规划分析报告》
同时前瞻产业研究院还提供产业大数据、产业研究报告、产业规划、园区规划、产业招商、产业图谱、智慧招商系统、行业地位证明、IPO咨询/募投可研、IPO工作底稿咨询等解决方案。在招股说明书、公司年度报告等任何公开信息披露中引用本篇文章内容,需要获取前瞻产业研究院的正规授权。
更多深度行业分析尽在【前瞻经济学人APP】,还可以与500+经济学家/资深行业研究员交流互动。
广告、内容合作请点这里:寻求合作
咨询·服务

