十张图了解2018年药品审评审批情况 按时完成率大幅提高,积压数量显著减少
2018年,药审中心完成审评审批的注册申请共9796件,其中完成需技术审评的注册申请7988件(包含4052件需技术审评的行政审批任务),完成直接行政审批的注册申请1808件;受理新注册申请共7336件,排除历史积压注册申请,中药、化药、生物制品各类注册申请按时限审评审批率已超过90%,基本完成《关于改革药品医疗器械审评审批制度的意见》中规定的发展目标。在各类药品中,化药完成审评数量占据主流,但占比有所下降;生物制品完成审评数量逐年增长,占比不断上升,且审评通过率超过七成,为所有类别药品中通过率最高的类目。
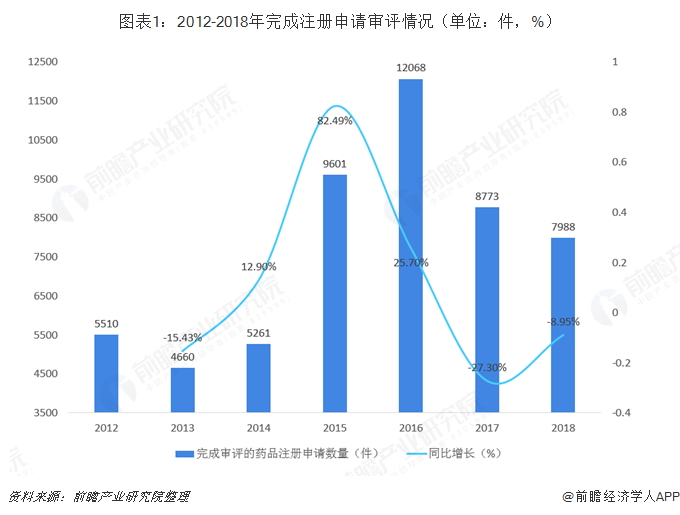
按时审批率超过90%,积压数量显著减少
2015年8月9日,国务院印发《关于改革药品医疗器械审评审批制度的意见》,其中提出要提高药品审评审批效率,简化药品审批程序,完善药品再注册制度,主要目标之一为解决注册申请积压。严格控制市场供大于求药品的审批。争取2016年底前消化完积压存量,尽快实现注册申请和审评数量年度进出平衡,2018年实现按规定时限审批。2018年,药审中心完成审评审批的注册申请共9796件,其中完成需技术审评的注册申请7988件(包含4052件需技术审评的行政审批任务),完成直接行政审批的注册申请1808件;受理新注册申请共7336件,排除历史积压注册申请,中药、化药、生物制品各类注册申请按时限审评审批率已超过90%,基本完成44号文件中规定的发展目标。
2018年底排队等待审评审批的注册申请已由2015年9月高峰时的近22000件降至3440件,积压数量显著减少,药品审评审批效率进一步提高。
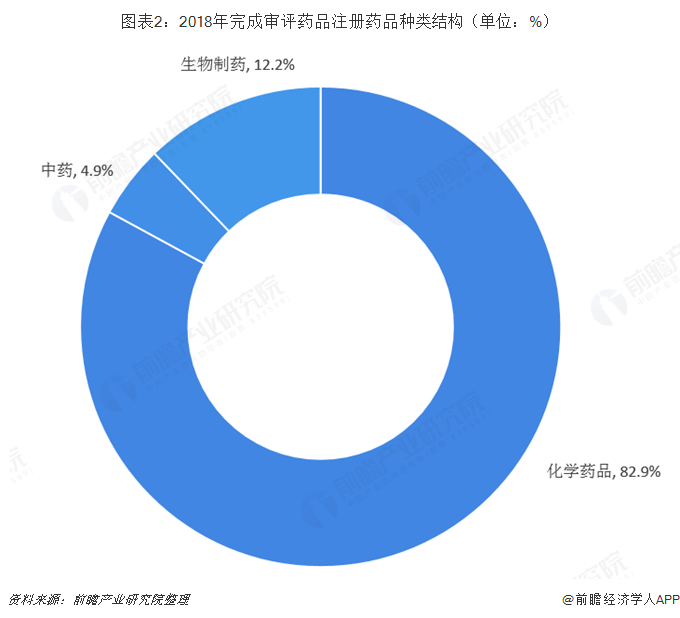
在2018年完成需技术审评的药品注册申请中,依然是化学药品占据主流。2018年,完成化药注册申请技术审评6624件,占全部审评完成数量的82.9%;其次为生物制品,完成注册申请技术审评971件,占全部审评完成量的12.2%。
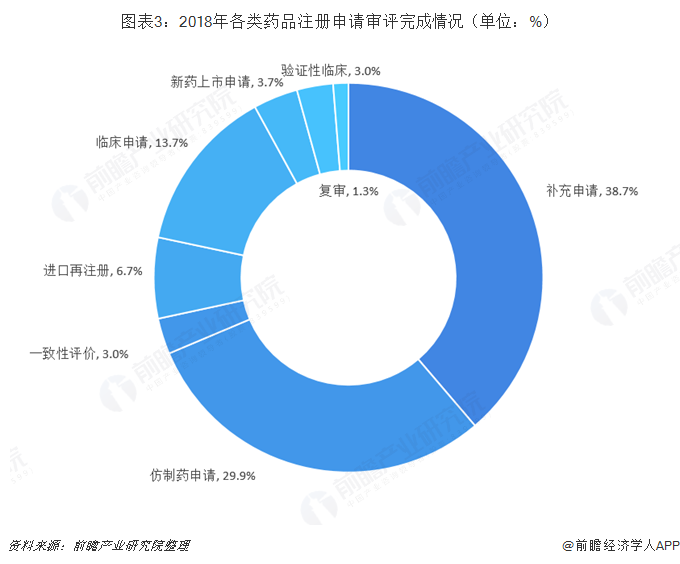
2017年10月8日,国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》中指出,促进药品创新和仿制药发展,坚持鼓励创新与促进药品仿制生产、降低用药负担并重,定期发布专利权到期、终止、无效且尚无仿制申请的药品清单,引导仿制药研发生产,提高公众用药可及性。完善相关研究和评价技术指导原则,支持生物类似药、具有临床价值的药械组合产品的仿制。加快推进仿制药质量和疗效一致性评价。随着政策的出台实施,仿制药(ANDA)完成注册申请审评开始逐步增多,2017年,仿制药(ANDA)完成注册申请审评为4152件,达到历史最高值,2018年出现下降,全年累计完成仿制药注册申请审评2388件,但仍为完成注册申请审评药品中种类最多的部分。
2018年,仿制药完成注册申请占比29.9%;完成临床药物注册申请1094件,占比13.7%;完成新药上市申请296件,占比3.7%。
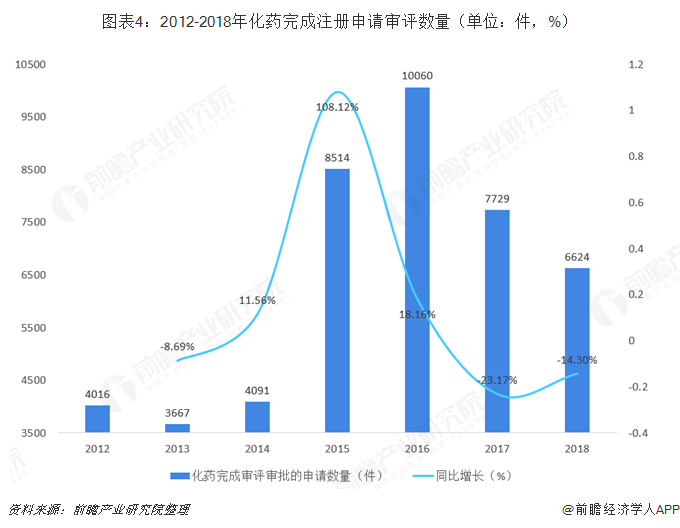
化药完成申请数量占比下降,仿制药占据主流
在药审中心历年药品完成注册申请审评中,化学药品完成注册申请审评数量始终占据主流地位,不过在2015年《关于改革药品医疗器械审评审批制度的意见》印发后,2016年化药完成注册申请审评数量占比达到了88.68%的高峰,之后两年占比出现了下降情况。2018年,化药完成注册申请审评数量为6624件,较上年同比下降14.30%,在完成审评数量占比也下降至82.92%。
根据《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》精神指示,促进药品创新和仿制药发展。2018年化药完成注册申请审评中,完成仿制药审评数量占据主流。2018年化药完成注册申请审评数量为6624件,其中ANDA数量为2353件,占全部完成审评化药数量的35.5%;完成化药临床申请(IND和验证性临床)共843件,占全部完成审评化药数量的12.7%。
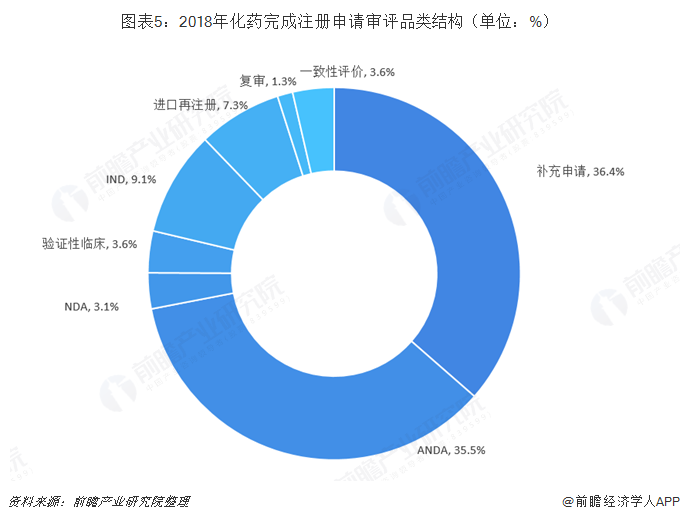
2018年,药审中心完成审评的化药注册申请整体通过率约为60.76%。其中,IND的通过率最高。2018年,药审中心完成审评的化药IND共计603件,其中554件审评通过,通过率达到91.87%;ANDA通过率最低,2018年,药审中心完成审评的化药ANDA共计2353件,仅有1038件审评通过,通过率仅有44.11%。

中药完成申请数量占比下降,整体通过率较低
在药审中心历年药品完成注册申请审评中,中药完成注册申请审评数量始终占比较小,在2015年《关于改革药品医疗器械审评审批制度的意见》印发后,2016年中药完成注册申请审评数量达到了历史最高值,全年累计完成注册申请审评1362件,当年中药完成注册审评占比为11.29%。之后两年占比出现了下降情况,2018年,中药完成注册申请审评数量为393件,较上年同比上升7.38%,2017年和2018年中药在完成审评数量占比分别下降至4.17%和4.92%。
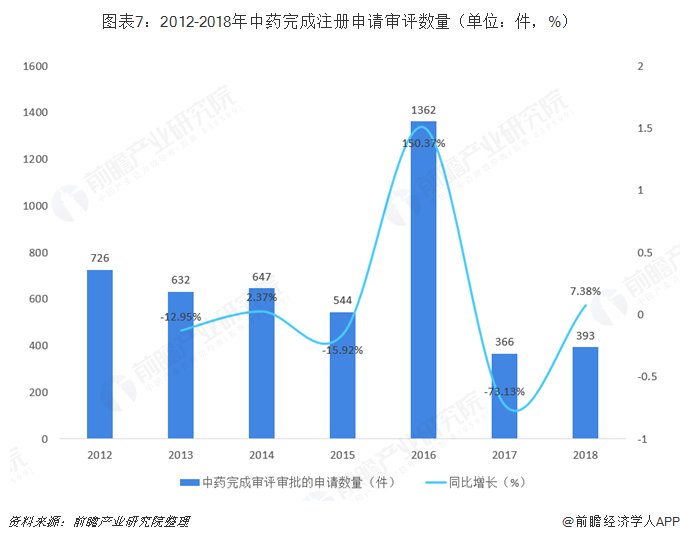
中药注册申请审评通过率整体较低,2018年,药审中心完成审评的中药注册申请整体通过率约为47.58%。其中,IND的通过率最高,2018年,药审中心完成审评的中药IND共计61件,其中44件审评通过,通过率达到72.13%;ANDA通过率最低,2018年,药审中心完成审评的中药ANDA共计35件,但无一项通过,通过率为0%,近三年我国中药ANDA通过率均在5%以下,中药仿制药建设仍需加强。

生物制品完成申请数量上升较快,整体通过率超过七成
在药审中心历年药品完成注册申请审评中,生物制品完成注册申请审评数量呈逐年上升趋势,2018年,生物制品完成注册申请审评数量为971件,较上年同比增长48.22%,在完成审评数量占比也由2013年的9.67%上升至2018年的12.16%。

2018年,药审中心完成审评的生物制品注册申请整体通过率约为70.44%,在各类药品中审评通过率最高。在各类生物制品审评中,治疗用IND的通过率最高。2018年,药审中心完成审评的生物制品治疗用IND共计377件,其中316件审评通过,通过率达到83.82%;治疗用NDA通过率最低,2018年,药审中心完成审评的生物制品治疗用NDA共计63件,仅有30件审评通过,通过率仅有47.62%。

以上数据及分析均来自于前瞻产业研究院《中国医药行业市场前瞻与投资战略规划分析报告》
更多深度行业分析尽在【前瞻经济学人APP】,还可以与500+经济学家/资深行业研究员交流互动。
广告、内容合作请点这里:寻求合作
咨询·服务


