仿制药一致性评价加速行业整合 研发外包公司将受益
近日,CFDA发布了《关于开展仿制药质量和疗效一致性评价的意见(征求意见稿)》,要求对已经批准上市的仿制药,凡没有按照与原研药质量和疗效一致的原则审批的,均需按照相应原则开展一致性评价。
前瞻分析,国内仿制药标准的提高配合临床试验数据的真实性核查将进一步加速整个国内仿制药行业的洗牌,优质药品研发企业及CRO公司将从中受益。
仿制药一致性评价带动行业整合
多年来,中国制药行业一直保持在“仿制药大国”的现状。据前瞻产业研究院发布的《2016-2021年中国医药商业市场前瞻与投资战略规划分析报告》显示,2014年化药批准上市品种中,仿制药220个,占54%的市场份额。目前国内创新原研药少,仿制药处于无序竞争中,价格战此起彼伏;“专利悬崖”为仿制药企业制造了巨大的机会,药企都在抢占高毛利仿制药品种,特别在肿瘤、乙肝、糖尿病、哮喘等领域等。
图表:我国仿制药品占据半壁江山
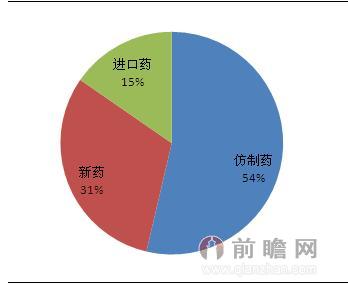
资料来源:前瞻产业研究院整理
而在此政策影响下,我国仿制药药企无疑再次站在重新洗牌的支点上。对于药企来说,仿制药的质量一致性评价工作开展以后,受到影响的可能不仅仅是药品质量不能达到一致性标准的企业。一些过分依赖个别“首仿”品种,产品线单薄的制药企业和过早抢仿3.1类药物(指已在国外上市销售但未在国内上市销售的原料药及其制剂)的企业,尤其是过去两年国际上一些专利药过期以后便抢先仿制的企业都会在这次改革中受到影响。随着研发门槛的提高,对于以生产“仿制药”为主的企业来说,很有可能挺不过去从而退出市场。
另外一方面,这对于国内有研发能力的药品制造企业来说可谓利好消息。国内拥有较多特殊审批品种的恒瑞医药表示,他们非常欣赏国家层面在药品审评审批方面做出的重大改革,这将极大地改善我国制药创新环境,对创新的支持力度很大,有利于促进国内制药企业研发创新的积极性,对国内新药的质量水平提升和上市速度预计都会有较大的意义。
严格要求下研发外包热或出现
按SFDA相关领导介绍,2018年国家基药目录里所有的化学药品种要求全部完成仿制药一致性评价,其他品种则要求再注册时完成一致性评价,否则取消药品文号,不得上市销售。目前国内近5000家药厂中有3/4没有独立研发能力,在此背景下,为通过评价,CRO(医药研发合同外包服务机构)公司或将受到热捧。
前瞻分析,国内除了少数研发实力强的药企可以独立完成该项工作外,大部分药企更有可能外包给CRO公司来协助完成。由于中小药企或不具备条件的药企研发进行外包,不仅可以减轻药企在专业人才引进、设备购置、专家网络合作等方面的大量投入,还能真正实现“让专业的公司干专业的事”。如此一来,药企便可集中精力做好生产和营销。
但是我国在未来很长的一段时间内都仍将是以仿制药为主,如此多药企也无法全部涌到生产领域而放弃其他市场,而国外大型药企因专注新药研发和生产,将许多非关键性技术外包研发的模式在国内还需要时间去消化。
广告、内容合作请点这里:寻求合作
咨询·服务

